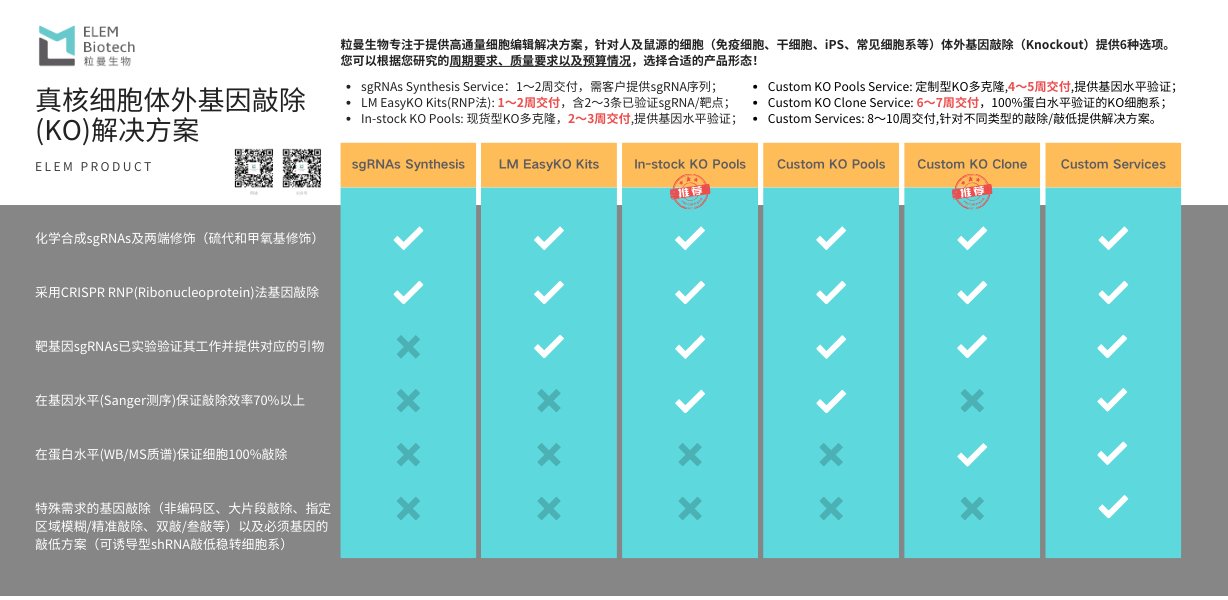
1.什么是KO细胞池(KO Cell Pool ) ?
一定数量的野生型细胞系,通过基因编辑方法(慢病毒、质粒法及RNP法等)转染后,获得的一群成功编辑与未成功编辑的细胞混合物。
2.为什么选择KO Cell Pool?
(1) KO Pool的制备时间相比细胞系更短,成本更低,可以快速获得基因功能验证结果;
(2) 遗传多样性:KO Cell Pool通常包含了多个不同的敲除细胞,这种多样性更接近自然状态下细胞群体的遗传异质性。这种多样性可以提供更全面的数据,帮助研究者理解基因敲除对细胞群体的影响,而不仅仅是单一细胞系的影响。
(3) 实验结果的稳定性:由于包含多种敲除细胞,KO Cell Pool在一些实验中显示出更高的稳定性和可重复性。在单克隆细胞系中,任何基因敲除引起的非预期变异或适应性变化都可能导致实验结果的波动,而在细胞池中,这种影响可能被多样性所平衡。
(4) 适用于复杂的生物学问题:对于研究复杂的生物学问题,如多基因互作、信号通路等,使用KO Cell Pool可能更为合适。多样性确保了不同类型的敲除细胞可以模拟复杂的生物过程,提供更接近生理状态的实验条件。
3.如何获得真正意义上的KO细胞系(KO Cell Line ) ?
(1) KO多克隆细胞(KO Cell Pool)通过逐级稀释/流式分选/单克隆细胞分选技术的方法,获得的单克隆细胞,并通过Sanger测序确认其基因型为确切的片段丢失或移码突变,才是真正意义上的KO单克隆细胞系(KO Cell Line)。慢病毒及质粒法获得的KO Pool,是通过药物筛选获得单克隆,只能确定质粒整合到基因组上,不能确定其是否发生真正的基因编辑,仍需要通过后续的实验来验证是否真正发生基因编辑。
(2) 什么是KO细胞系纯合子?野生型细胞的所有等位基因都发生有效的基因编辑(非3倍数的移码突变或超过21个氨基酸的片段丢失),而不存在野生型的基因,即为纯合子基因敲除细胞系。由于基因编辑的概率性问题,很难实现等位基因发生完全相同的编辑位点,但不存在野生型基因,即为成功的纯合子。
CRISPR/Cas9 RNP基因编辑法是将靶基因对应的多条体外化学合成的single-guide RNA(sgRNA)与Cas 9蛋白体外混合形成核糖核蛋白复合物(Ribonucleoprotein,即:RNP),通过电转化/脂质体转染的方式,以类似“瞬时”转染的流程将 RNP 递送到细胞体内,无需通过传统的慢病毒 / 质粒法的抗性筛选过程,即可获得高效、稳定遗传的细胞池。由于 RNP 在细胞内 72h 内完成基因组编辑后就会被降解,不引入外源序列,尽可能保持细胞表型,是目前脱靶效应最低的方式,可有效避免病毒基因组随机整合,而影响后续功能性实验,避免传统方法中Cas9 和 sgRNA 持续表达造成细胞基因组不稳定及高脱靶风险。CRISPR/Cas9 RNP 法进行基因敲除细胞系构建已经在路上,将全面替代传统方式。下图为CRISPR/Cas9 RNP基因编辑法的基本流程。
粒曼提供真核细胞体外基因敲除定制服务,针对该服务,粒曼团队将定期更新Q&A,便于更好地服务我们的客户。Q&A【2409版】如下问题:
您这边提供细胞名称和靶向基因ID即可(需要是唯一ID,例如 Gene symbol,Gene ID,Ensembl ID),我们会通过粒曼数据库查询基因必需性(ES值)和该基因在目标细胞上的表达情况,以此给您提供相关评估结果(是否建议做基因敲除,或者做敲低)。
基于粒曼独有的基因编辑数据库(不对外提供),含有超过在700个细胞系中每个基因对细胞生长产生影响的评估。ES值用于判断靶基因在特定细胞中敲除是否会影响细胞生长。ES值越高,敲除后对细胞生长影响越大,会有较大难度拿到稳定的细胞系。
我们可以编辑人/鼠源的免疫细胞系/肿瘤细胞系/正常细胞系/原代细胞/干细胞等用于体外功能研究;用于人体内实验的细胞编辑根据国际伦理原则,我们不承接。
4.我要准备做基因敲除项目的话,需要提供相关细胞吗?
我们项目的细胞来源有三种途径。一是客户自己提供(需保证细胞无支原体污染,有额外的检测和培养费用);二是使用粒曼生物细胞库的细胞,三是我们有固定且有口碑的细胞供应商,可以帮您代采购细胞。
以细胞A549(倍增时间~22h)为例,细胞复苏调整细胞状态至可以电转,安排电转获得KO效率,扩培获得KO Pool,单克隆铺板至筛选获得单克隆。
整体上我司获得KO Pool在2-4周左右,获得KO单克隆(纯合子)在8-10周左右。不同倍增时间的细胞,其相关项目周期会有些波动。
6.KO Pool(多克隆)和KO Cell line(单克隆)的区别是什么?
KO Pool就是野生型细胞经过敲除之后变成一个多克隆,在Pool中基因敲除细胞的基因型是不一样的,有片段丢失的或者移码突变的,同时也可能存在少量的野生型细胞。Pool的敲除效率也是可能达到100%的,只是基因型不是单一的。而单克隆是基因型完全一致的细胞系,达到100%的敲除效率。
我们采取CRISPR RNP法(Cas9与sgRNA形成复合物)替代传统的慢病毒和质粒法在提高编辑效率的同时,避免了基因组重组引起脱靶效应。利用我们领先的sgRNA设计,我们提供编辑后KO效率的分析服务,将您从繁琐的病毒包装、质粒制备、Cas9浓度测试等优化实验中解放出来,专注于生物学发现。
粒曼的设计有三点,第一点是靶向编码功能蛋白的早期外显子;第二点是靶向靶基因多个isoforms的共享外显子;第三点是基因组低脱靶分析。
针对感兴趣的蛋白设计特异性sgRNA,采用电穿孔方法将sgRNA与Cas9复合物(RNP)
转入细胞,sgRNA将cas9靶向染色体上的特定位点,使相应基因产生移码或片段丢失。
10.KO电转时是将几条sgRNA混在一起还是转单条?
根据不同靶点,我们会设计高特异性,低脱靶效应的2-3条sgRNA混合在一起电转。
11.多条sgRNA放到一起转细胞,会不会导致较高的脱靶?
研究表明RNP方法的脱靶效率要远远小于病毒法和质粒法。一是sgRNA设计靶向高度特异。二是RNP半衰期短只有72小时,很快会降解,所以脱靶概率低。这也是RNP法优于慢病毒的一点。
12.RNP转染以后没有荧光和抗性基因,怎么判断转染呢?
RNP的方法效率非常高,做完瞬转(电转)之后就开始编辑了不需要荧光/抗性筛选 3天之后可以拿到稳定ko多克隆细胞系。由于Pool的敲除效率非常高,一般达到70%以上,这样可以很高效的分离到单克隆敲除纯合子。
13.使用的电穿孔的方法进行敲除,请问对照组是否也同样使用了电穿孔?
对照组不需要电转,电穿孔对细胞只是一个瞬时穿孔(几十毫秒),细胞膜具有流动性很快可以恢复。大量研究表明电转化与脂质体转化相比,细胞具有更好的耐受性。也就是说,采用RNP法进行基因敲除,对照组细胞就是野生型细胞,无需准备空载质粒进行共转染。
利用我司优化的sgRNA设计软件,筛选合适的靶位点,针对每个靶基因设计多条sgRNA,以增加多位点切割概率提高敲除效率; 根据sgRNA序列,自动生成匹配的PCR引物用于扩增基因组编辑位点,再通过sanger一代测序结果,使用粒曼专有软件进行分析,获得编辑后KO基因型分析结果。
15.测序是对敲除的那一段测序,还是对整个基因进行测序?
我们设计引物只扩增编辑位点,一个PCR产物可以包含所有sgRNA的切割编辑位点,从而确定对目标的编辑效率。我们目前不提供全基因组测序。
我们的细胞交付标准是1管冻存KO细胞和相关的基因敲除报告(包含基因敲除效率和细胞培养方法)以及相关测序原始数据。此外,粒曼提供蛋白水平的验证结果,采用WB验证或者蛋白质谱验证方式。
如果您需要更多的KO细胞,我们有相应的收费标准,具体标准可与我们销售联系。
17.我拿到KO Pool之后,不用抗生素,是怎么筛选单克隆株?
对于KO效率高且遗传稳定的KO Pool绝大多数情况下是可以直接用于表型筛选和测试的。如果需要单克隆,可以通过常规的单克隆培养方式进行,例如有限稀释,流式分选,或单细胞微流控分离等。
根据我司质控标准,纯合子为等位基因均发生敲除(大片段缺失或移码),交付的单克隆为基因组不存在野生型序列即为纯合子,交付的纯合子在等位基因的移码或片段丢失不能保证完全一致,但是可以保证没有野生型蛋白表达。
19.我收到1管冻存细胞后,如果复苏后,没有培养成功,后续还会提供给我吗?
我们交付的每个项目细胞都是有备份的,如果您没有复苏成功的话,在您接收细胞1个月内我们可以免费提供1支冻存细胞给到您,也可以给您提供相应的细胞培养的技术支持。
20.做完敲除,WB实验结果还是会有条带,请问为何会出现这种现象?
如果您做的是KO Pool:从基因型上分析,含有15%的野生型序列,这可能是导致弱条带的原因,可以将KO Pool进行单克隆筛选,获得稳定遗传的单克隆细胞系。另外要注意有些基因有类似的转录子或高度同源的蛋白存在。需要对目标基因和所用验证抗体的特异性进行综合考虑。
问题解读 I 为什么WB实验不完全适用于KO细胞的敲除效率评估(1)
问题解读 I 为什么WB实验不完全适用于KO细胞的敲除效率评估(2)
问题解读 I 为什么说蛋白质谱验证是KO细胞敲除验证的黄金标准?【珍藏】
服务指南 I 粒曼高通量基因敲除定制服务(RNP法)Q&A【2409版】