技术专题|TurboID邻近标记技术助力液液相分离(LLPS)动态互作网络研究!【珍藏】
2025-05-20

拓展阅读【邻近标记技术相关技术专题】
技术专题 | 破解细胞内蛋白互作密码:邻近标记技术在生物研究中的价值与选择策略【收藏】
技术专题 | 蛋白邻近标记(PL):蛋白互作研究的新标配【收藏】
拓展阅读【液液相分离相关技术专题】
技术专题 | 液-液相分离 (LLPS):现代生物医学中的新前沿【珍藏】
一、摘要
细胞内生物大分子通过相分离形成的无膜细胞器,是复杂生命活动的“动态舞台”。深入解析这些凝聚体的组分和相互作用网络,是理解其功能乃至疾病机理的关键。然而,相分离凝聚体的动态性和瞬时性给传统研究方法带来了挑战。本文将详细解读一项革命性的邻近标记技术——TurboID,及其在生物大分子相分离研究中展现出的非凡能力与广阔前景。我们将探讨这项技术的开发历程、核心优势,并结合前沿研究案例,展现TurboID如何成为我们解析相分离“微世界”的强大“分子探针”。
二、研究背景与意义:捕捉瞬息万变的分子社交圈
生命体是一个高度组织化的复杂系统,细胞内的蛋白质、核酸等生物大分子并非孤立存在,而是通过精确的相互作用形成复杂的网络,共同执行各项生理功能。近年来,“生物大分子相分离”作为一种重要的细胞组织原理被广泛关注。蛋白质和核酸等通过液-液相分离形成各种无膜凝聚体(Condensates),如应激颗粒、P-body、核仁等,这些凝聚体是细胞功能的核心场所,参与基因表达、信号转导、代谢调节等几乎所有重要的细胞过程。
然而,相分离形成的凝聚体往往具有高度的动态性和瞬时性。它们的形成、解离以及组分交换可能在秒级甚至毫秒级完成。传统的蛋白质相互作用研究方法,如免疫共沉淀(Co-IP),通常需要在细胞裂解后进行,难以捕捉活细胞内瞬时或弱的相互作用,更难以精确分析特定亚细胞区域(如相分离凝聚体内部)的蛋白质组成。因此,开发能够在活细胞内、以高时空分辨率捕获蛋白质邻近相互作用的新技术,对于深入理解细胞微环境尤其是动态变化的相分离凝聚体至关重要。
正是在这样的背景下,邻近标记技术(Proximity Labeling)应运而生并迅速发展。这类技术利用酶或其他分子机器在目标蛋白附近催化化学反应,将生物素等小分子标记到邻近的蛋白质或核酸上,随后通过生物素亲和捕获并结合质谱等手段鉴定这些被标记的分子。其中,由华人科学家Alice Ting(邓红文教授)团队开发的TurboID技术,凭借其卓越的标记效率和更快的反应速度,成为了该领域的佼佼者。
三、主要研究结果:从BioID到TurboID的速度飞跃与功能拓展
早期的邻近标记技术代表BioID,虽然概念巧妙,但其生物素化酶BirA的活性相对较低,需要较长的标记时间(通常长达18-24小时),这限制了其在研究快速动态过程中的应用。为了突破这一瓶颈,Ting团队采取了定向进化(Directed Evolution)的策略,对大肠杆菌的生物素连接酶BirA进行了系统的改造(如图1所示)。

图1 TurboID 的定向进化开发历程:基于定向进化的酶工程策略
通过多轮的突变、筛选和优化,他们成功开发出了活性显著增强的BirA突变体:TurboID,以及尺寸更小的衍生版本 miniTurbo。相比于BioID,TurboID和miniTurbo展现出以下核心优势(如表1所示):
- 显著提升的生物素化活性
标记速度成百上千倍提升,将所需标记时间从传统的18小时大幅缩短至惊人的10分钟甚至更短。
- 更短的标记时间窗口
这种超高的效率使得TurboID能够更精准地捕捉瞬时发生的蛋白质相互作用或空间邻近关系,对于研究动态过程(如信号转导、细胞器组装解体)具有无可比拟的优势。
- miniTurbo的小尺寸优势
miniTurbo的分子量约为TurboID的一半,这使其更易于通过基因编辑等方式递送,产生更小的空间位阻,可能更适合与某些对融合标签大小敏感的蛋白融合。
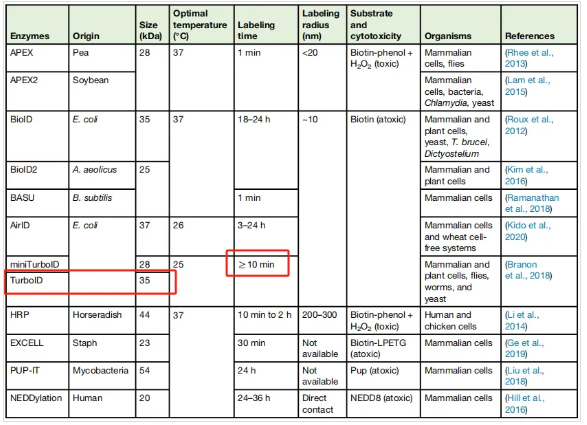
表1 用于鉴定蛋白质相互作用的邻近标记酶的对比
除了基础版本的TurboID和miniTurbo,科学家们还在此基础上进行了持续的创新和功能拓展,以实现更精细的调控和更广泛的应用。
- Split-TurboID(分裂型TurboID)
将TurboID酶拆分成两个无活性的片段,只有当这两个片段因为目标蛋白质的相互作用或空间接近而重组时,酶活性才能恢复(如图2所示)。这实现了对标记过程的更精细的空间和相互作用依赖性控制,特别适合研究特定分子互作发生时的邻近环境。
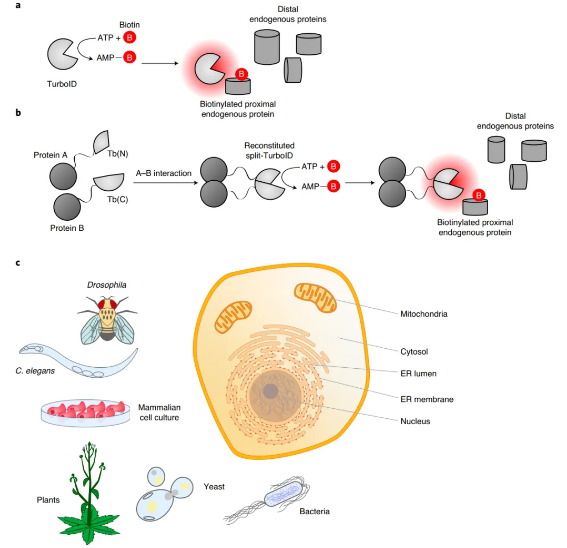
图2 TurboID和split-TurboID催化的邻近依赖性生物素化
- Opto-TurboID(光遗传学TurboID)
将TurboID与光敏蛋白模块结合(如图3所示),利用光信号作为“开关”来精确控制酶的激活。这种技术实现了对标记过程的毫秒级时间控制,使得研究对时间高度敏感的生物学事件成为可能。
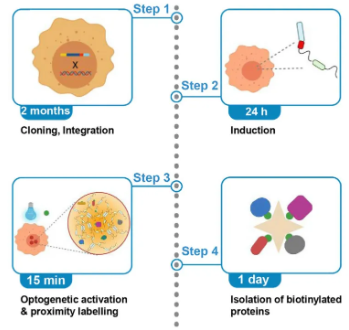
图3 Opto-TurboID技术原理示意图
- TransitID(蛋白运输TurboID)
通过巧妙设计分泌型和膜锚定型TurboID酶(如图4所示),TransitID技术能够动态追踪蛋白质在细胞内外的运输路径及其沿途遇到的分子。这为研究细胞分泌、内吞、膜蛋白转运等过程提供了强大工具。
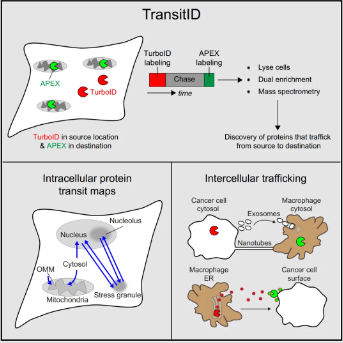
图4 TransitID技术原理示意图
这些TurboID的衍生技术极大地扩展了邻近标记技术的应用范围和精细程度,使其能够适应更复杂的生物学问题研究。
四、TurboID在生物大分子相分离研究中的独特价值
正如前文所述,相分离凝聚体的动态性和复杂组分是研究的难点。TurboID技术凭借其高效、快速和活细胞标记的特性,在相分离研究领域展现出了独特的优势,正在成为解析凝聚体“分子微环境”和动态组分的强大工具。TurboID技术在相分离研究中的优如下。
- 广泛适用性:已成功应用于应激颗粒、P-body、核仁、甚至藻类蛋白核等多种类型的相分离凝聚体研究,证明其普遍有效。
- 高效动态标记:标记时间短至数分钟,能够有效捕获凝聚体快速形成、解离或组分交换过程中的瞬时相互作用蛋白。
- 区域特异性:通过将TurboID融合到特定的凝聚体组分蛋白上,可以实现对凝聚体内部或其紧邻区域的特异性标记。
- 兼容复杂体系:适用于研究低丰度蛋白、膜蛋白,甚至在疾病状态下细胞环境更复杂的相分离事件。
- 靶点筛选:高效鉴定疾病相关或特定条件下形成的相分离凝聚体的核心组分和潜在互作蛋白。
五、邻近标记技术在相分离领域的典型应用案例
TurboID已被用于解析多种重要的相分离相关生物学过程。
1. PD-L1调控与肿瘤免疫逃逸 [5]
研究发现,肿瘤细胞中的KAT8-IRF1复合物通过相分离形成核内凝聚体(如图5所示),高效招募转录机器,显著上调免疫检查点蛋白PD-L1的表达,从而帮助肿瘤细胞逃避免疫杀伤。TurboID在此研究中用于鉴定KAT8相分离凝聚体的邻近蛋白,揭示了相分离在肿瘤免疫逃逸中的新机制。
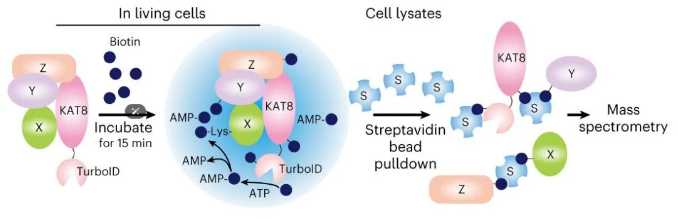
图5 V5-TurboID标签的KAT8的邻近标记系统示意图
2. HERD-1凝聚体与跨代遗传 [6]
在线虫的研究中,TurboID技术被用来分析HERD-1蛋白形成的凝聚体(如图6所示)。研究揭示,HERD-1凝聚体参与调控小RNA介导的跨代遗传。这意味着通过相分离调控的表观遗传机制,上一代的生活经历(如环境胁迫)可能通过影响凝聚体组分和功能,进而影响后代的性状。

图6 PZMS区室的建立和TurboID标记的优化
3. TRIAD3A与tau蛋白病理聚集 [7]
一项研究发现E3泛素连接酶TRIAD3A通过“嵌套相分离”(nested phase separation)促进tau蛋白的淀粉样纤维化。TurboID被用于筛选TRIAD3A的邻近蛋白(如图7所示),成功鉴定出包括tau蛋白在内的多种与神经退行性疾病相关的蛋白。这项工作提示相分离在神经退行性疾病中可能扮演了关键角色,并为阿尔茨海默病等疾病机制提供了新视角。

图7 TRIAD3A介导的自噬货物候选物的鉴定
4. TPM4相分离调控糖酵解与微丝动态 [8]
研究利用TurboID-MS技术发现,在高渗应激下,微丝结合蛋白TPM4会发生相分离形成凝聚体(如图8所示),并招募多种糖酵解酶(如HK1、PGK1等),在局部产生ATP,从而反馈调控微丝骨架的重排。这项研究首次揭示了相分离在细胞骨架重塑与能量代谢偶联中的枢纽作用。
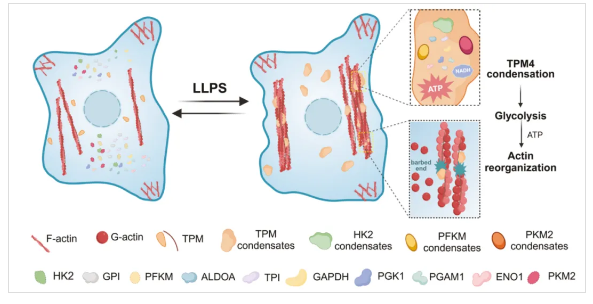
图8 用于TPM4相分离介导的多种糖酵解酶的重组的模型示意图
这些案例生动地展示了TurboID技术在揭示相分离凝聚体组分、互作网络及其功能机制方面的强大能力。
六、研究的重要性/影响:解析活细胞动态的新钥匙
TurboID技术的问世及其后续的优化和拓展,是对传统蛋白质相互作用研究方法的一次重要革新。其核心重要性体现在:
- 突破时空分辨率限制:将邻近标记的效率提升到前所未有的水平,使得我们能够在活细胞内以极短的时间窗口捕捉瞬时和动态的分子事件。
- 赋能复杂体系研究:尤其适合研究难以分离、高度动态或位于特定微环境中的蛋白质复合体或凝聚体,如相分离形成的无膜细胞器。
- 推动新兴领域发展:TurboID已成为相分离、细胞器相互作用、蛋白转运、甚至神经突触动态研究等前沿领域的重要工具,加速了这些领域的发现进程。
- 提供新的研究视角:邻近标记不仅识别直接相互作用蛋白,还能揭示空间上接近的分子,为理解细胞微环境和功能区划提供了独特的视角。
可以说,TurboID及其变体正在帮助我们以前所未有的视角,解析活细胞内部复杂而动态的分子社交网络。
七、研究的局限性:强大工具背后的挑战
尽管TurboID功能强大,但在应用过程中仍需注意其潜在的局限性:
- “邻近”而非“互作”:TurboID标记的是与目标蛋白空间位置接近的分子,这些分子可能并非直接相互作用,也可能是由于共同定位在某个亚细胞结构中而被标记。因此,鉴定到的“邻近蛋白”列表需要进一步的实验验证(如Co-IP、GST-pull down等)来区分直接互作和空间邻近。
- 融合标签的影响:将TurboID融合到目标蛋白上可能会影响目标蛋白的表达、定位、稳定性或其自身的相互作用。虽然miniTurbo尺寸较小,但这种可能性仍需考虑。
(推荐阅读:技术专题 | 破解细胞内蛋白互作密码:邻近标记技术在生物研究中的价值与选择策略【收藏】)
- 标记效率和特异性:酶的表达水平、生物素浓度、标记时间等因素都会影响标记效率和特异性。过高的表达或过长的标记时间可能导致非特异性标记。需要仔细优化实验条件并设置恰当的对照(如表达弥散分布的TurboID作为背景对照)。
- 生物素本身的影响:虽然通常认为外源添加的生物素对细胞影响微弱,但在某些特定条件下或对特定细胞类型的影响仍需评估。
- 定量分析的复杂性:虽然结合质谱可以进行定量蛋白质组学分析,但解释蛋白的富集程度需要严谨的实验设计和统计学分析,以区分真实的邻近富集与背景噪音。
认识到这些局限性,并结合其他研究方法进行验证,是充分利用TurboID技术获取可靠结论的关键。
总结:TurboID邻近标记技术助力您的相分离研究
- 从一名长期关注生物大分子相分离的研究者角度来看,TurboID技术的出现无疑是该领域的一座“灯塔”。相分离研究的魅力在于其高度的动态性和复杂性,而这恰好是传统技术难以企及的盲区。TurboID以其“快、准、狠”的特点,为我们提供了一把在活细胞真实环境中“速写”相分离凝聚体组分的利器。
- 特别值得称赞的是,这项技术并非停滞不前,Split-TurboID、Opto-TurboID、TransitID等一系列的拓展,展现了科学家们不断追求更精细控制和更广阔应用前景的努力。这些创新使得我们能够更精准地探究特定时空、特定互作状态下的分子环境。
- 当然,没有任何技术是完美的。TurboID的邻近性特点要求我们在解读数据时保持审慎,并强调后续的验证工作。但总的来说,TurboID极大地降低了研究相分离凝聚体组分的门槛,加速了我们对这些动态分子实体功能理解的进程。它不仅仅是一种技术,更是推动相分离乃至整个细胞生物学领域发展的重要驱动力。可以预见,未来会有更多基于TurboID的创新应用涌现,为揭示生命的奥秘贡献力量。
(推荐阅读:文献解读|AirID:蛋白质相互作用研究的新篇章【收藏】)
我们依托专业的团队能力,提供基于TurboID邻近标记技术的专业研究服务,旨在助力科研工作者高效、精准地解析“相分离凝聚体”的分子组成和互作图谱。该技术利用工程化生物素连接酶在活细胞内以高时空分辨率标记目标蛋白的邻近分子,尤其适用于捕捉动态、瞬时或弱相互作用,在相分离研究中展现出卓越性能。
参考文献
[1] Branon TC, et al. Nat Biotechnol. 2018. doi:10.1038/nbt.4201
[2] Cho KF, et al. Nat Protoc. 2020. doi:10.1038/s41596-020-0399-0
[3] Alghoul E, et al. STAR Protoc. 2021. doi:10.1016/j.xpro.2021.100677
[4] Qin W, et al. Cell. 2023. doi:10.1016/j.cell.2023.05.044
[5] Wu Y, et al. Nat Cancer. 2023. doi:10.1038/s43018-023-00522-1
[6] Zhao C, et al. Nat Cell Biol. 2024. doi:10.1038/s41556-024-01514-8
[7] Zhou J, et al. Nat Cell Biol. 2024. doi:10.1038/s41556-024-01461-4
[8] Yang W, et al. Cell Discov. 2024. doi:10.1038/s41421-024-00744-2
2025 /
05-20
所属分类:
行业新闻
相关资讯—
2025-07-08
2025-07-08

