技术专题|邻近标记技术:打开"LLPS相分离研究"的“隐秘角落”!【收藏】
2025-07-10

一、背景简介:研究相分离,不能只靠“看得见”的
近年来,细胞相分离(Phase Separation)成为生命科学前沿研究的热点之一。研究发现,众多关键细胞活动(如转录调控、染色质重塑、信号转导等)都依赖于非膜包裹的生物分子凝聚体。这些结构通过液-液相分离(LLPS)形成,并能动态聚集或解聚,发挥“分区反应容器”的作用。
但问题是:这些凝聚体往往高度动态、可逆、无膜结构,传统的蛋白互作鉴定手段(如Co-IP、免疫共沉淀、传统质谱)难以准确捕捉其真实组成。
于是,邻近标记(Proximity Labeling, PL)技术横空出世,成为研究相分离结构以及核心机制最有力的分子工具之一。
二、技术演化:邻近标记,从原理到精确定位
2.1 技术原理概览
邻近标记是一种利用工程化酶(如BioID、APEX、TurboID等)将“可识别化学修饰”特异地添加到目标蛋白周围的技术。修饰通常是生物素化,可被高亲和力的链霉亲和素捕获后,用于蛋白鉴定(LC-MS/MS)或可视化蛋白互作定位,具有保持天然生理状态、高灵敏、非破坏性等优点。
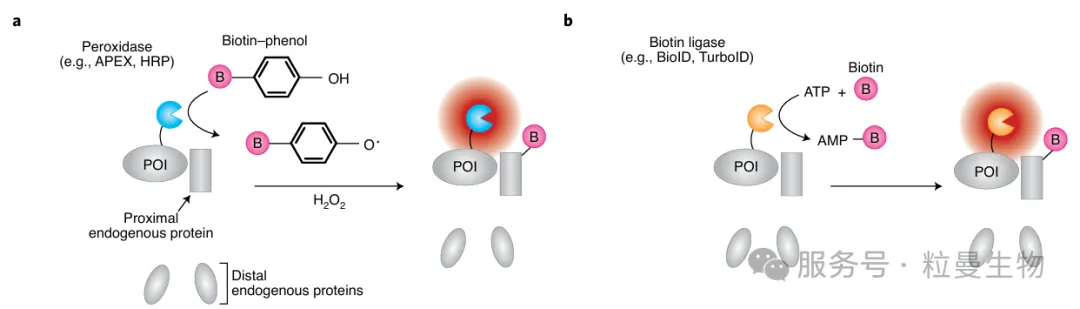
图1[1]
2.2 技术发展时间线
|
年份 |
技术 |
说明 |
|
2012 |
BioID(Roux et al.) |
利用突变型BirA(BirA*)在细胞中缓慢生物素化邻近蛋白(>6小时) |
|
2015 |
APEX2(Lam et al.) |
基于过氧化物酶反应,快速(<1 min)标记邻近蛋白,适合亚细胞膜结构研究 |
|
2018 |
TurboID / miniTurbo(Branon et al., Nat Biotechnol) |
高效快速(<10 min),适用于活细胞和动物模型 |
|
2019~2022 |
Split-PL / proximity labeling with phase-separation sensors |
向更高空间特异性和时序控制演化,用于研究瞬时或聚集依赖性的互作 |
三、邻近标记 × 相分离:为什么是“黄金搭档”?
3.1 可捕捉动态、弱亲和的蛋白质网络
相分离结构的组成蛋白常常不稳定、非特异性、高动态性。邻近标记技术能在天然状态下原位标记“近邻”蛋白,哪怕它们之间没有稳定结合,也能被高效标记。
3.2 时空分辨能力强
如APEX、TurboID只需1–10分钟反应时间,能用于监测瞬时形成或解离的相分离结构,尤其适合研究信号诱导相分离过程。
3.3 适用于跨膜、核膜、应激颗粒等难处理亚结构中的蛋白互作识别
APEX2 对膜/线粒体/核仁等结构标记效率较高而TurboID 适合进行时间控制下的颗粒组分谱绘制。
3.4 适配多种模型系统
从细胞系、动物模型(如C. elegans、斑马鱼、果蝇)到原代细胞或iPSC衍生系统,邻近标记可通过瞬转、稳转、病毒或CRISPR-KI等多种方式实现。
四、技术应用实例:相分离研究中的明星案例
案例1:TurboID-MS用于研究相分离调节代谢与结构重塑
该研究采用TurboID-MS技术发现[2],在高渗透压应激条件下,微丝结合蛋白TPM4通过相分离形成凝聚体,选择性富集糖酵解酶(如HK1、PGK1等),促进局部ATP的产生,进而调节微丝骨架的重组。邻近标记技术帮助精确捕获了TPM4凝聚体周围的蛋白组分,揭示其在调控相分离相关功能中的关键作用,为理解细胞在环境胁迫下通过相分离调节代谢与结构重塑提供了有力工具。
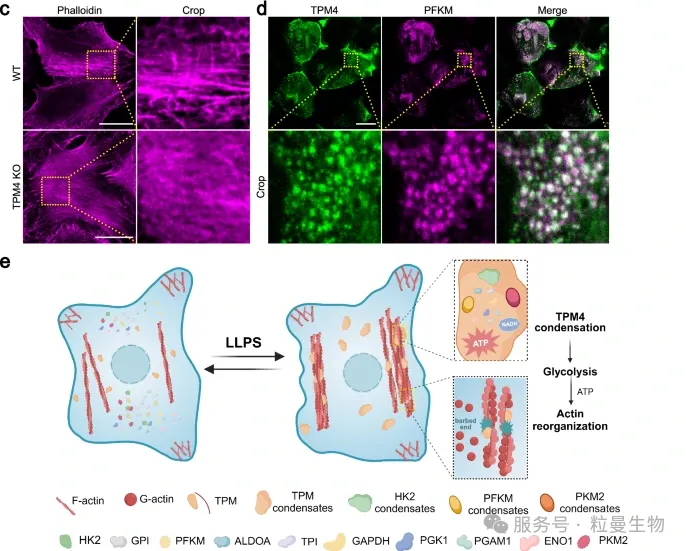
案例2:Split-TurboID用于识别接触依赖的相分离结构蛋白互作
在该研究中[3],邻近标记技术通过Split-TurboID系统实现了蛋白相互接触依赖的精准标记。研究者将TurboID酶分为两段,分别融合至两个目标蛋白,只有在二者空间接近或形成相互作用时,TurboID功能才得以恢复并启动生物素标记,从而显著降低非特异性背景。该方法首次将邻近标记技术成功应用于液-液相分离界面、膜接触区和动态信号复合物的特异性蛋白互作解析,为研究细胞内复杂空间结构的蛋白组提供了高精度工具。
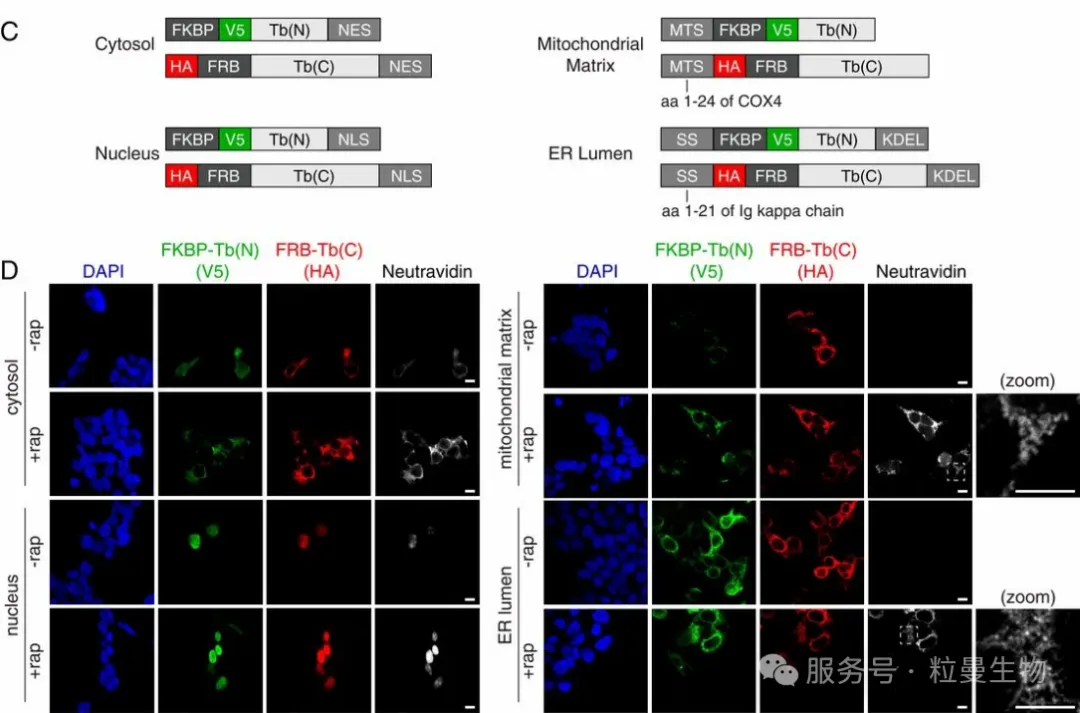
案例3:邻近标记用于刻画相分离颗粒的内部结构与动态重塑
在该研究中,作者利用抗体引导的邻近标记技术(Antibody-guided APEX labeling)[4],靶向应激颗粒核心蛋白G3BP1,实现了对应激颗粒(Stress Granules, SGs)内外层蛋白的空间分辨标记。通过比较不同诱导条件下SG的标记谱,揭示了SG在结构上存在组成异质性(compositional heterogeneity),并识别出一系列诱导特异性或层级分布的功能蛋白。该研究首次证明了邻近标记技术可以用于精细刻画相分离颗粒的内部结构与动态重塑,为理解相分离结构的分区功能和病理调控机制提供了强有力的工具。
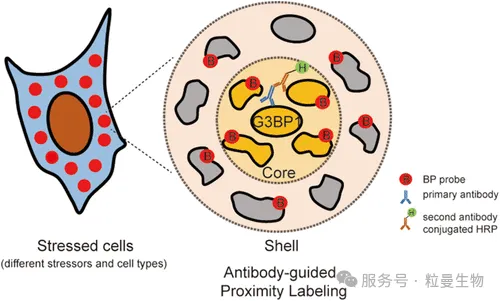
案例4:TurboID可视化相分离中蛋白互作
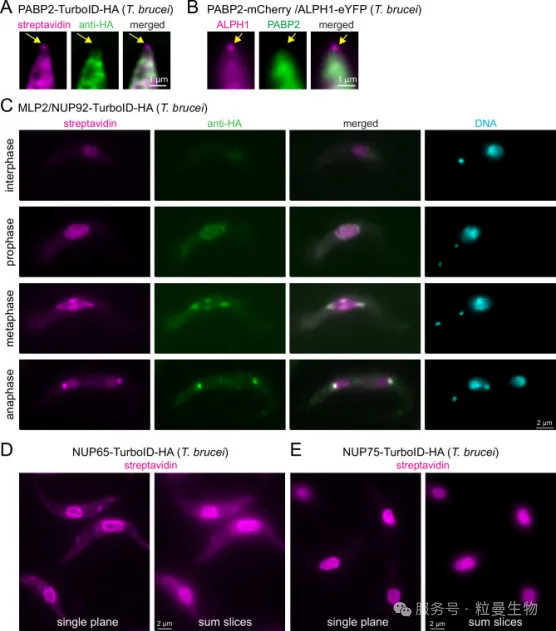
在该研究中[5],作者发现传统抗体难以进入高密度相分离结构(如应激颗粒、核仁)检测TurboID融合蛋白,而荧光链霉亲和素(fluorescent streptavidin)可直接识别TurboID标记的生物素化位点,从而实现对相分离颗粒中目标蛋白的准确成像和定位。该工作强调了邻近标记在相分离研究中的成像优势和空间分辨能力,为克服抗体屏蔽效应、提升蛋白定位精度提供了关键策略,拓展了TurboID在原位识别与功能分析中的应用深度。
五、常见技术推荐组合与建议
|
技术平台 |
优势 |
适合研究 |
|
TurboID-KI + 相分离突变体 |
高时效、适合内源融合 |
动态颗粒蛋白组识别 |
|
APEX2-C端融合 |
纳米级定位、膜结构标记优 |
膜结合或核仁LLPS |
|
Split-TurboID |
分片激活、高空间特异性 |
验证相互作用是否依赖LLPS |
|
TurboID + DIA-MS |
靶向定量、背景可控 |
相分离体动态演化 |
六、邻近标记,是打开相分离“黑箱”的金钥匙
在相分离研究中,我们不只关注蛋白聚集,更想知道:谁在一起?何时在一起?因何而聚?如何解离?
邻近标记技术正是回答这些问题的关键工具。无论你是研究应激颗粒、核糖体组装、染色质凝聚,还是开发生物药物作用机制——邻近标记都是你解构相分离世界的利器。
粒曼生物提供基于邻近标记技术的相分离服务:
1、邻近标记细胞系构建(过表达/原位插入细胞系构建);
产品发布|粒曼Gene tagging: N/C端原位插入,助力相分离/临近标记/蛋白降解等热门领域
技术专题 | 破解细胞内蛋白互作密码:邻近标记技术在生物研究中的价值与选择策略【收藏】
2、生物素标记细胞系效率验证(WB);
3、液滴共定位细胞内验证(共聚焦显微成像);
4、互作蛋白质谱分析以及蛋白图谱构建(LC-MS)。
有相关需求请联系我们!
参考文献
[1] Qin W, Cho KF, Cavanagh PE, Ting AY. Deciphering molecular interactions by proximity labeling. Nat Methods. 2021 Feb;18(2):133-143.
[2] Yang, W., Wang, Y., Liu, G. et al. TPM4 condensates glycolytic enzymes and facilitates actin reorganization under hyperosmotic stress. Cell Discov 10, 120 (2024).
[3] K.F. Cho,T.C. Branon,S. Rajeev,T. Svinkina,N.D. Udeshi,T. Thoudam,C. Kwak,H. Rhee,I. Lee,S.A. Carr,& A.Y. Ting, Split-TurboID enables contact-dependent proximity labeling in cells, Proc. Natl. Acad. Sci. U.S.A. 117 (22) 12143-12154.
[4] Miao E, Yang D, Yue X, Zhang Z, Liu H, Qin H, Ye M. Revealing Stress Granule Compositional Heterogeneity through Antibody-Guided Proximity Labeling. Anal Chem. 2025 Apr 22;97(15):8313-8321.
[5] Odenwald J, Gabiatti B, Braune S, Shen S, Zoltner M, Kramer S. Detection of TurboID fusion proteins by fluorescent streptavidin outcompetes antibody signals and visualises targets not accessible to antibodies. Elife. 2024 Aug 29;13:RP95028.
2025 /
07-10
所属分类:
行业新闻
相关资讯—
2025-12-01
2025-12-01

