技术专题 | CRISPRa:精准激活,重塑基因表达【收藏】
2025-04-02
一、概述
CRISPR-Cas9技术自2012年首次被发现以来,迅速成为基因编辑领域的重要工具。随着该技术的发展,科学家们逐渐在此基础上发展出两种重要的调控工具——CRISPR干扰(CRISPRi)和CRISPR激活(CRISPRa)。这两种技术并不直接编辑DNA序列,而是通过特定的分子机制调节基因的表达水平,从而在基因调控研究、疾病治疗及生物工程等领域展现出巨大的潜力。本技术专题将重点对 CRISPRa 技术进行详细介绍。
参考阅读:技术专题 | CRISPRi干扰技术:基因调控新工具【收藏】
二、CRISPRa(CRISPR激活)
2.1 工作原理
与CRISPRi不同,CRISPRa利用了同样的dCas9蛋白,但它通过与转录激活因子(如VP64、p65和NF-kB等)的融合,激活目标基因的转录。这些激活因子能够促进RNA聚合酶的结合和转录的启动,从而提高目标基因的表达水平。CRISPRa技术能够在不改变基因序列的情况下,实现精确的基因激活[1]。
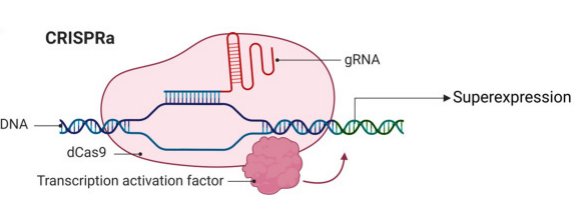
图1 CRISPRa原理简图
2.2 常用的转录激活因子
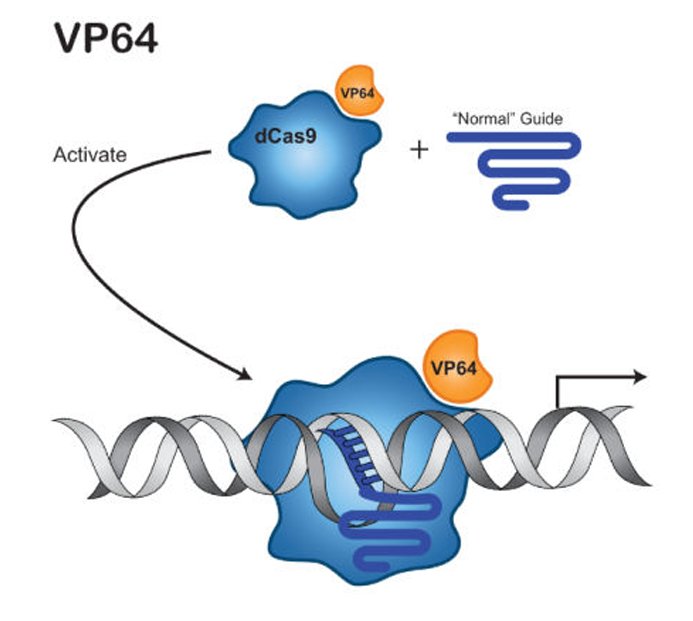
2.2.1 VP64
- 简介:单纯疱疹病毒(Herpes Simplex Virus, HSV)VP16 蛋白的四聚体。
- 作用机制:VP64 通过与 CBP(CREB 结合蛋白)、p300(转录共激活因子)等相互作用,促进 RNA 聚合酶 II(Pol II)的募集,增强目标基因的转录。VP64 主要作用于启动子区域,激活能力适中[2]。
2.2.2 p65(NF-κB RelA 亚基)
- 简介:NF-κB 信号通路的转录因子。
- 作用机制:p65 通过与 CBP/p300 结合,促进染色质重塑,提高目标基因的转录激活能力。可增强 RNA 聚合酶 II 复合体的组装,从而提高转录效率。
2.2.3 Rta(Replication and Transcription Activator)
- 简介:来源于EB 病毒(Epstein-Barr Virus)
- 作用机制:通过促进组蛋白乙酰化,改变染色质结构,提高目标基因的转录水平。Rta 主要作用于增强子区域,有助于提高基因激活效率。
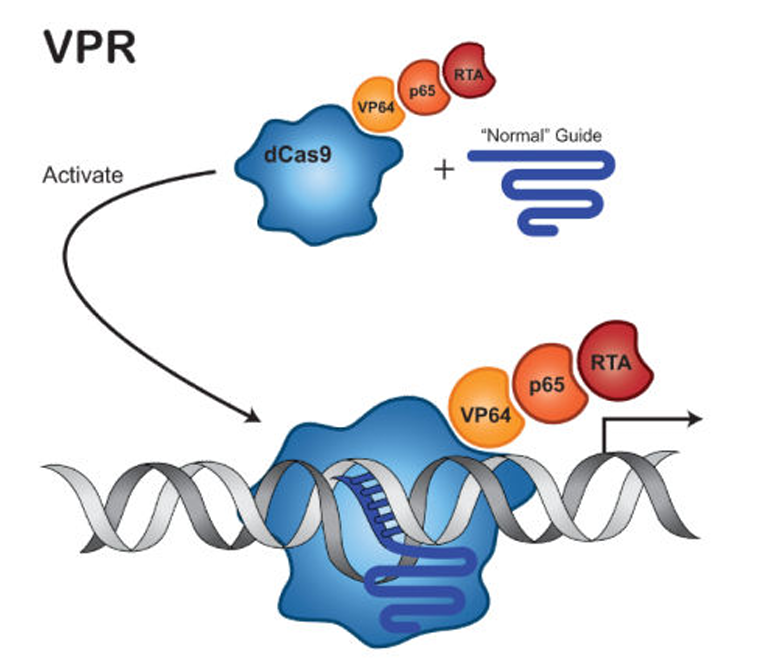
2.2.4 VPR(VP64-p65-Rta)system
- 简介:VP64 + p65 + Rta
- 作用机制:VP64 主要招募转录共激活因子;p65 增强 RNA 聚合酶 II 的募集;Rta 进一步增强染色质开放性。相比单一 VP64,VPR 复合系统能更强地激活基因表达,适用于较难激活的基因。
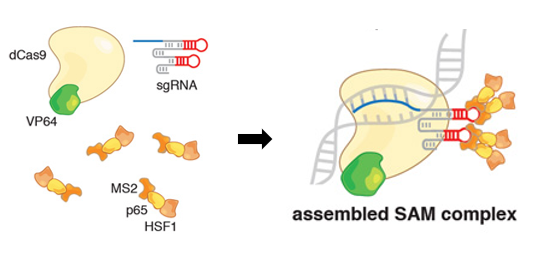
2.2.5 SAM(Synergistic Activation Mediator)system
- 简介:MS2 修饰的 gRNA + dCas9-VP64 + MS2-P65-HSF1
- 作用机制:gRNA 经过 MS2 修饰,能够结合 MS2 融合蛋白(p65-HSF1);p65 提高 RNA 聚合酶 II 的活性;HSF1(热休克因子 1)促进 RNA 聚合酶 II 释放,提高转录延伸效率。由于 MS2 结构可增强活化因子的募集,该系统比单纯 VP64 更高效,适用于高效基因激活实验[3]。
2.2.6 SunTag(Supernova Tagging)system
-
简介:dCas9 + 10–24 个 VP64 重复结构 + 抗体片段(scFv)
-
作用机制:在 dCas9 尾部连接多个 VP64,使其增强对目标基因的激活能力;scFv(单链可变片段抗体)用于稳定结合多个 VP64,提高激活效率。可实现超强基因激活效果,但构建较为复杂。

2.3 CRISPRa与传统过表达的比较
CRISPRa 与经典的基因过表达(Overexpression, OE)方法(如质粒转染、慢病毒表达系统以及转座子系统等)相比,具有以下不同点:

2.4 应用场景
2.4.1 基因过表达研究
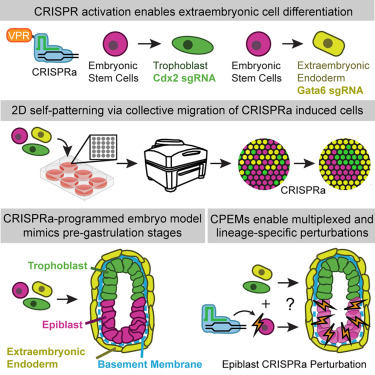
CRISPRa使得研究人员能够在特定细胞类型或动物模型中过表达某些基因,用于探索这些基因在生物学过程中的作用。特别是在研究疾病发生、胚胎发育等时,CRISPRa技术提供了一个强有力的工具。研究开发了一种新的 mESCs 编程方法[4],通过 CRISPRa 在体外重现胚胎早期发育过程,提供了一种无需重组蛋白或化学诱导剂的策略,使干细胞直接按照内源性基因调控网络进行自组织。为再生学和发育生物学研究提供新工具,有助于解析早期胚胎模式形成的机制,并为合成生物胚胎研究提供新的方法。
2.4.2 研究可变剪切
CRIAPRa能够激活剪切调控因子,研究其对 RNA 剪切模式的影响。通过在不同细胞类型中诱导特定剪切变体的表达,解析剪切变异的功能。
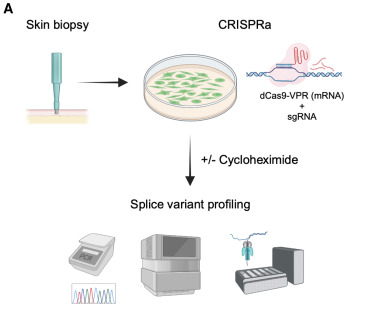
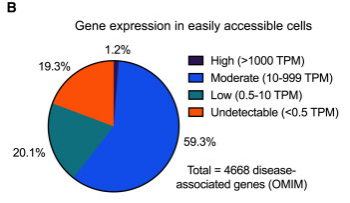
为了解决在易于获取的细胞中无法进行RNA诊断的挑战,该研究设计了一种基于CRISPRa的剪接检测方法[5],用于体外激活感兴趣基因的表达。研究展示了基于CRISPRa的剪接分析如何解决罕见神经疾病患者基因变异的剪接致病性,从而扩大了进行全面RNA诊断的可能性。CRISPRa在罕见疾病研究中的未来应用可能为利用临床可获得的组织带来新的见解铺平道路。
2.4.3 研究肿瘤耐药
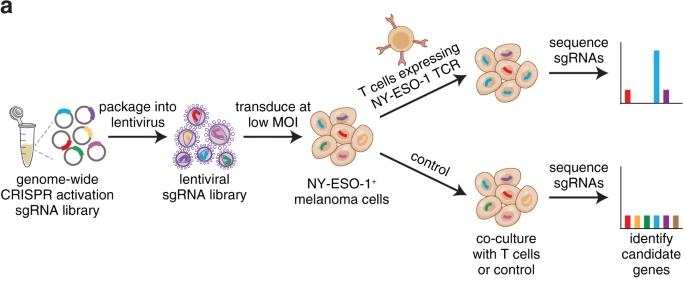
该研究通过CRISPR激活筛选(CRISPRa Screen)发现BCL-2和B3GNT2是癌细胞对细胞毒性T细胞产生耐药性的关键驱动因子验[6],抑制这两个蛋白可以增强肿瘤组织对免疫疗法的敏感性。这一结果表明,CRISPR激活筛选系统有助于阐明耐药途径并确定癌症免疫治疗的潜在靶标。
三、参考文献
[1] Almeida RS, et al.CRISPR/Cas9 Genome-Editing Technology and Potential Clinical Application in Gastric Cancer. Genes (Basel). 2022 Nov 4;13(11):2029.
[2] Chavez A, et al.Comparison of Cas9 activators in multiple species. Nat Methods. 2016 Jul;13(7):563-567.
[3] Konermann S,et al.Genome-scale transcriptional activation by an engineered CRISPR-Cas9 complex. Nature. 2015 Jan 29;517(7536):583-8.
[4] Lodewijk GA,et al.Self-organization of mouse embryonic stem cells into reproducible pre-gastrulation embryo models via CRISPRa programming. Cell Stem Cell. 2025 Mar 19:S1934-5909(25)00083-9.
[5] Terkelsen T, et al.CRISPR activation to characterize splice-altering variants in easily accessible cells. Am J Hum Genet. 2024 Feb 1;111(2):309-322.
[6] Joung J, et al.CRISPR activation screen identifies BCL-2 proteins and B3GNT2 as drivers of cancer resistance to T cell-mediated cytotoxicity. Nat Commun. 2022 Mar 25;13(1):1606.
粒曼生物提供CRISPRa基因编辑服务,具体需求可联系我们咨询!
2025 /
04-02
所属分类:
行业新闻
相关资讯—
2025-12-08
2025-12-08
2025-12-08


