技术专题 | 破解细胞内蛋白互作密码:邻近标记技术在生物研究中的价值与选择策略【收藏】
2025-04-14
背景
在后基因组时代,如何理解细胞内蛋白质之间复杂且动态的相互作用网络,成为揭示生命活动奥秘的关键。邻近标记(Proximity Labeling)技术,作为一种新兴的蛋白互作捕获手段,因其高时空分辨率和适用于活细胞/活体等优势,正在成为生命科学研究的“利器”。
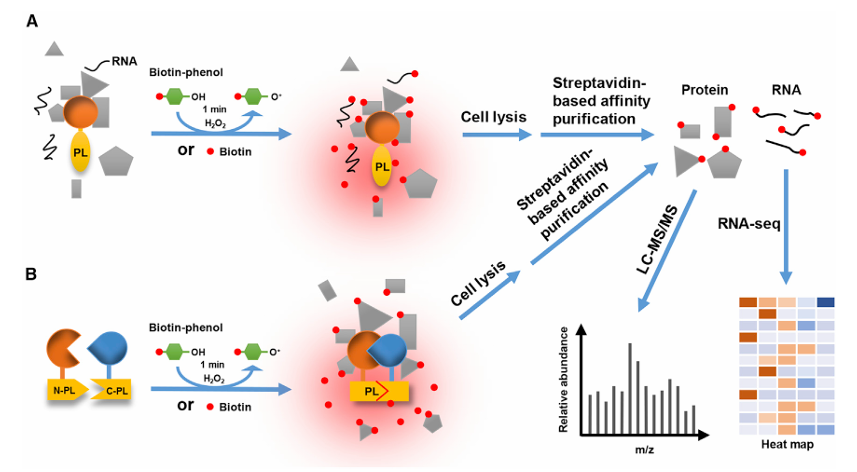
邻近标记流程图[1]
本文重点介绍邻近标记技术不同构建策略的优劣势对比,助您在科研设计中精准落点。
一、邻近标记技术简介
邻近标记是一种基于工程化酶的蛋白质相互作用探测方法。其核心原理是将具有催化活性的标记酶(如TurboID、APEX2、miniTurbo、AirID等)与目标蛋白融合表达,在特定条件下催化邻近蛋白质(5~10纳米范围)共价连接生物素等可捕获的标记物,从而通过链霉亲和素富集和质谱鉴定,解析目标蛋白的微环境。
补充阅读:文献解读|AirID:蛋白质相互作用研究的新篇章【收藏】
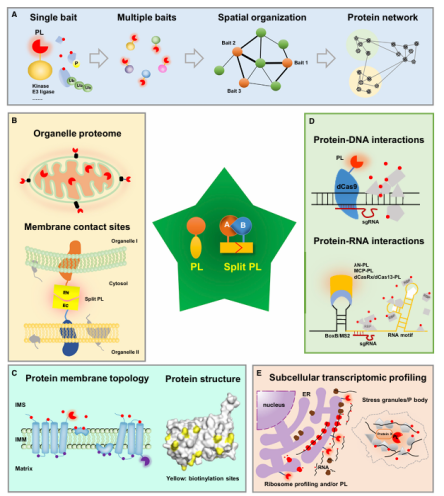
二、邻近标记的研究价值与典型应用
1)构建蛋白互作图谱(Interactome Mapping):揭示特定蛋白或复合物的邻近网络,补充传统免疫共沉淀法的盲区。
2)亚细胞定位微环境分析:将标记酶定位于细胞器(线粒体、溶酶体等)或膜结构,分析区域特异性蛋白组成。
3)蛋白转运与信号动态追踪:研究受刺激或药物作用下蛋白质复合体的组分变化。
4)活体动物互作研究:利用TurboID/miniTurbo的低毒性,可在小鼠或斑马鱼中研究组织特异性互作。
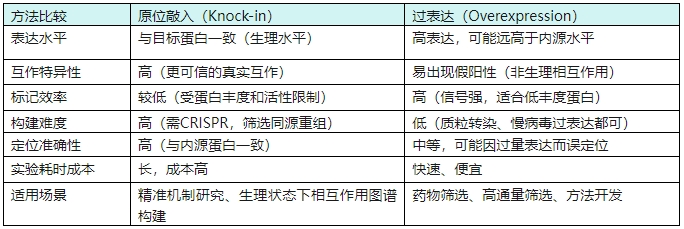
三、细胞系构建策略选择:原位敲入 vs 过表达融合
邻近标记系统在细胞系内的构建方式主要分为两类:
3.1 过表达融合(Over expression,OE)
3.1.1 原理
将融合蛋白(如 TurboID-目标蛋白)通过外源表达系统(如质粒、电转、病毒等)导入细胞,使其以较高表达水平存在,通常情况下为随机插入。
3.1.2 构建流程
1)克隆目标蛋白 + 邻近标记酶(如TurboID、APEX2)融合构建至表达载体。
2)使用质粒、慢病毒、腺相关病毒(AAV)等手段导入细胞。
3)表达确认后,加入底物(如生物素或biotin-phenol),进行标记实验。
3.2 原位插入(Endogenous Knock-in)
3.2.1 原理
通过CRISPR-Cas9等手段,将TurboID/APEX等邻近标记酶基因以融合形式插入内源基因位点(靶基因的N端/C端),实现内源表达调控的邻近标记。
3.2.2 构建流程
1)设计sgRNA靶向目标基因终止密码子前,即C端插入(或起始位点后-N端插入)。
2)准备含有TurboID等标签和同源臂的供体DNA。3)电转或病毒导入细胞,筛选敲入成功的单克隆。4)验证融合蛋白表达及功能完整性。
邻近标记构建方法比较
四、参考案列
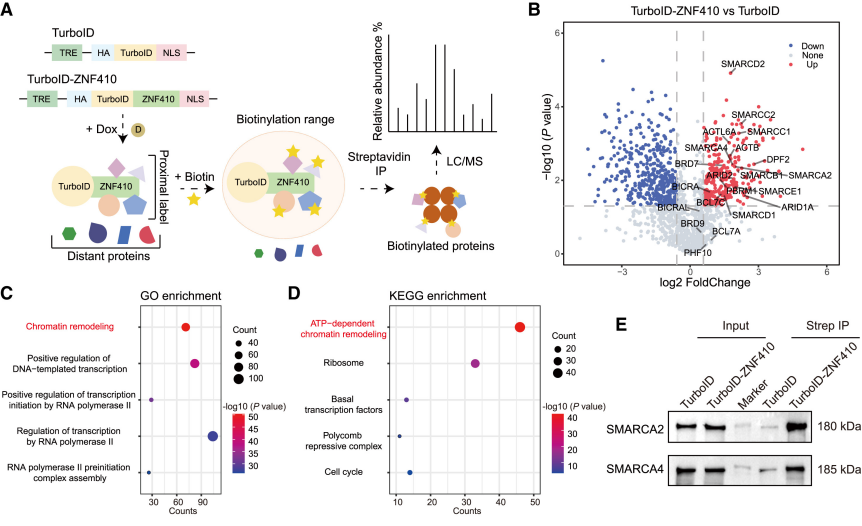
4.1 互作蛋白筛选(过表达)
研究人员通过将TurboID与ZNF410过表达融合[2],实现对ZNF410周围蛋白的生物素化,证实染色质重塑复合体SWI/SNF被ZNF410的N端选择性招募,二者通过协同作用驱逐核小体,确保ZNF410在增强子区域HCTs上的高效结合,进而维持CHD4增强子的染色质开放状态。
4.2 研究疾病作用机制(过表达)
研究人员发现了一种新型的调控tau病理聚集的机制[3]:TRIAD3A通过嵌套相分离促进tau淀粉样化。实验通过 TurboID 过表达融合 TRIAD3A 并在活细胞中标记其邻近蛋白,识别出包括tau在内的多个与神经退行性疾病相关的蛋白,该研究不仅强调了相分离结构的层级组织性在病理蛋白聚集中的重要作用;还提供了连接泛素系统、相分离与自噬清除之间的新思路,为阿尔茨海默病等疾病的干预策略提供潜在靶点。
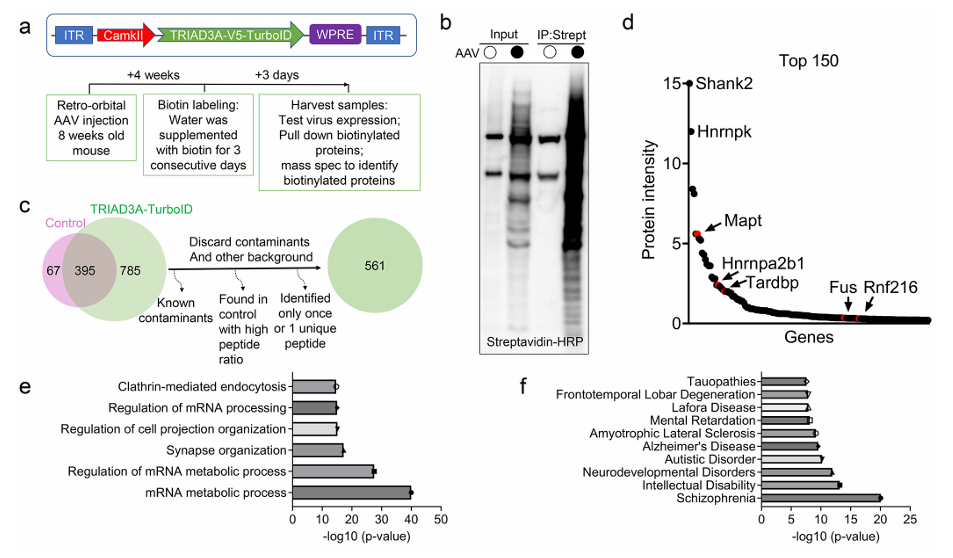
4.3 构建互作图谱(过表达 & 原位敲入)
研究人员全面比较了TurboID原位敲入(KI)与过表达(OE)在邻近标记实验中的性能差异,特别关注信噪比、互作蛋白的数量以及特异性等指标[4]。
1)Biotin labeling效率对比发现,OE样本中biotin信号非常强,但也伴有较多背景(无特异性标记);KI样本中biotin信号清晰,背景少,分布更接近目标区域。
2)分析两种方法鉴定出的互作蛋白,结果显示KI组显示出一系列高度显著的真实互作蛋白,背景蛋白较少;而 OE组虽检测到更多蛋白,但高背景掩盖了真实互作。3)对两组鉴定的互作蛋白做功能富集分析,结果证明,KI组富集出的生物过程与目标蛋白功能高度一致(如核内过程、染色质调控等),OE组出现大量非相关路径(如细胞外结构蛋白等)。
4)最后评估MS数据的整体质量,发现KI的方法灵敏度更高。
综上所述,研究者认为内源性表达的TurboID KI可以带来更特异、更准确、更生理相关的蛋白互作图谱,是比传统OE方法更优的策略。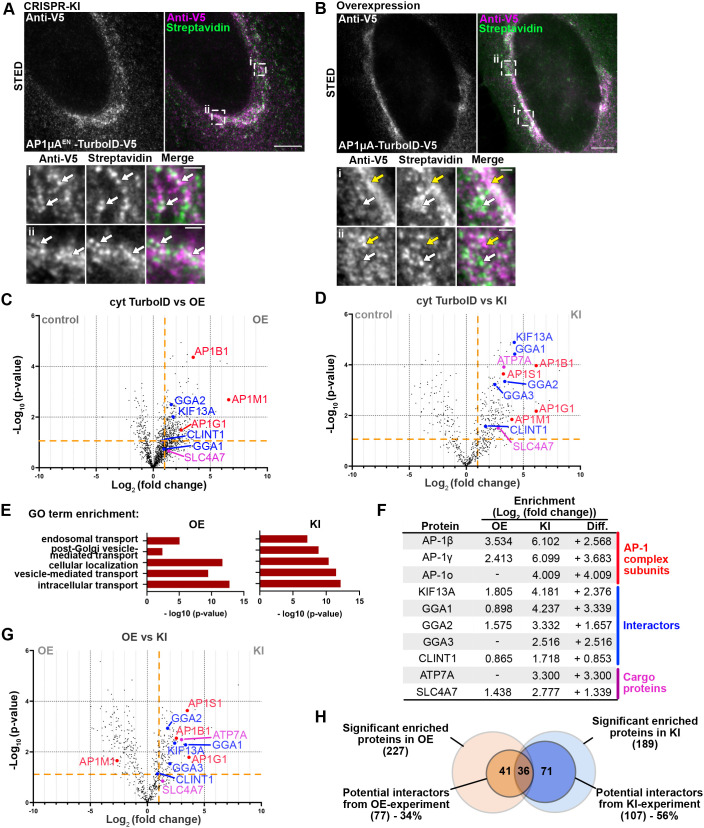
综上,我们按照不同应用场景推荐了不同的策略,供大家参考:
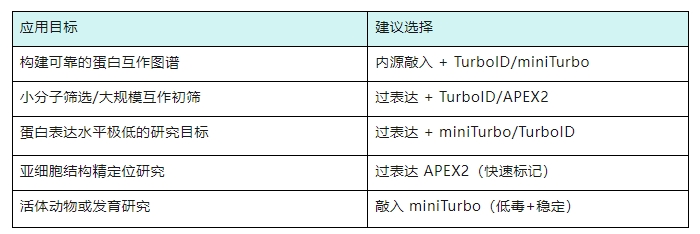
粒曼提供邻近标记全流程的服务(包括过表达/原位标记策略及strep亲和纯化及质谱检测),有需要可联系我们咨询!
粒曼针对“蛋白临近标记”的相关产品及服务:
1. 基因原位插入/过表达稳定细胞系构建:基因N端/C端原位插入birID,TurboID等标签用于临近标记检测,可发现蛋白-蛋白互作(弱互作、瞬时互作);原位插入Strep-tag等用于AP-MS检测,可发现本底水平下的强蛋白-蛋白相互作用;随机插入或安全港定点插入“标签-靶蛋白”,构建过表达细胞系,用于PL研究;
2. 粒曼strep II纯化填料:针对Strep-tag蛋白以及生物素标记的蛋白(例如临近标记后获得的)进行极高亲和力富集(比抗体富集的亲和力高100倍);
3. AP-MS/IP-MS检测:针对临近标记或者亲和标记(Strep-tag)的细胞样本进行质谱检测,发现互作蛋白;
4. 人/鼠源基因敲除阵列arrayed文库筛选:针对19+代谢通路(含300+ E3泛素连接酶KO阵列库,1000+ 泛素相关酶KO阵列库),更高精确性、数据解读简化、实验重复性强、研究需求更广。
五、参考文献
[1] Yang X, et al.Proximity labeling: an emerging tool for probing in planta molecular interactions. Plant Commun. 2020 Dec 15;2(2):100137.
[2] Xu S, et al.SWI/SNF complex-mediated ZNF410 cooperative binding maintains chromatin accessibility and enhancer activity. Cell Rep. 2025 Mar 28;44(4):115476.[3] Zhou J, et al.The autophagy adaptor TRIAD3A promotes tau fibrillation by nested phase separation. Nat Cell Biol. 2024 Aug;26(8):1274-1286.[4] Stockhammer A, et al. When less is more - a fast TurboID knock-in approach for high-sensitivity endogenous interactome mapping.J Cell Sci.2024 Aug 15;137(16):jcs261952.
2025 /
04-14
所属分类:
行业新闻
相关资讯—
2025-12-08
2025-12-08
2025-12-08

