粒曼合作 | 《PNAS》“膜蛋白降解器” 不依赖受体,突破LYTAC瓶颈,靶向膜蛋白降解的治疗新策略!
2025-06-30
【粒曼“蛋白降解药物领域产品系列”】正式发布!
粒曼生物团队在蛋白降解药物开发领域深耕,服务从靶点发现和确认、先导化合物发现和优化、药物机制( MOA)研究、PK/PD等环节;粒曼提供高通量基因编辑产品( KO/KI细胞系)及配套的质谱检测相关试剂和个性化服务,优化和加速上述研究进程。我们将通过该领域内的系列产品为药企客户及基础科研客户提供系列完整解决方案。
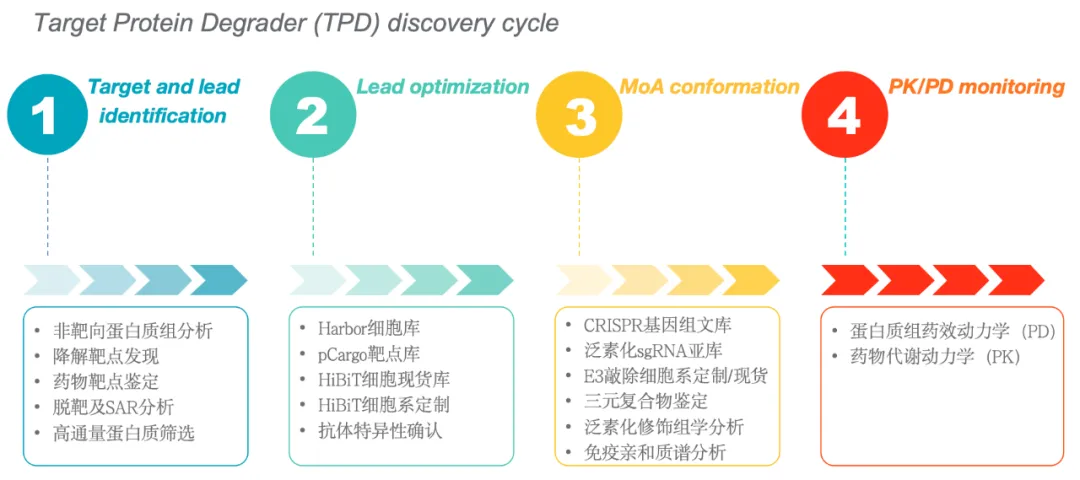
图1 粒曼在TPD领域内的产品及服务布局
参考阅读:产品发布|蛋白降解药物领域产品系列之“泛素化富集抗体”【收藏】;粒曼合作|粒曼泛素化富集抗体产品助力《Cell Reports》SCASP-PTM技术的临床应用潜力
基于E3泛素连接酶(E3 Ubiquitin Ligase)在蛋白降解药物(Targeted protein degradation, TPD)领域的关键作用,粒曼生物提供300+种E3 ligase KO敲除细胞系现货,请咨询我们,加快您的药物研发速度。
粒曼团队采用CRISPR RNP法助力本项《PNAS》的研究发现:通过CRISPR/Cas9 基因编辑定制化敲除 IGF2R 基因服务产品,构建 A549-IGF2R KO 细胞系,直接证明 SApt 不依赖 LTRs 的作用机制,为 “受体非依赖性” 这一核心创新提供了不可替代的实验模型,相关数据如下。

图1 敲除 IGF2R 基因证明 SApt 不依赖 LTRs
一、摘要
溶酶体靶向嵌合体(Lysosome-Targeting Chimeras, LYTAC)技术通过溶酶体通路实现细胞外和膜蛋白的选择性降解,为疾病治疗开辟了新方向。但细胞表面膜蛋白和分泌蛋白占编码蛋白的40%,在疾病发生与进展中发挥重要作用。溶酶体靶向该类蛋白降解较为困难。近期,来自中国科学院杭州医学研究所的渠凤丽和张慧科研团队开发出一种基于点击化学的创新技术——信号适配体嵌合体(SApt),有效突破了这一难题。该技术巧妙截取溶酶体相关膜蛋白 LAMP-2a 中的 YXXØ 溶酶体分选多肽基序,设计为融合肽序列。随后,通过简单的点击化学反应,将融合肽与特异性识别靶蛋白的核酸适体高效连接,构建出 SApt。实验证实,SApt 可快速降解 PTK7、Met、NCL 等多种膜蛋白,其作用机制在于核酸适体对靶蛋白的精准识别,以及 YXXØ 基序诱导的内吞作用,从而实现靶向蛋白的高效清除。这一技术的出现,为膜蛋白乃至胞内蛋白的降解提供了全新策略,有望加速靶向蛋白降解疗法的临床转化进程。
二、研究背景与意义
作为“扛把子” 选手,传统分子水平的靶向治疗主要依赖小分子抑制剂,这些抑制剂就像一把把精准的“小钥匙”,通过占据致病蛋白的活性结合位点,产生继发性抑制活性,从而达到治疗疾病的目的。然而,这看似完美的策略却有着难以忽视的“致命伤”。由于过度依赖靶蛋白中的结合位点,导致约 85% 的蛋白质组成为 “不可成药” 靶点。不仅如此,长期大剂量使用这些抑制剂,还可能引发严重副作用,甚至导致严重的耐药性,给患者和医生带来了巨大的困扰。
新兴的靶向蛋白降解(targeted protein degradation, TPD)技术巧妙地利用内源性细胞机制,将致病蛋白 “一网打尽”。它最大的亮点在于绕过了活性结合位点的限制,突破了传统治疗的瓶颈,为开发新型化学工具和药物发现策略开辟了一条全新的道路。
经典的TPD 技术,主要通过两个连接子连接的化学配体,将 E3 连接酶和目标蛋白(POI)“牵线搭桥”,促使它们形成三元复合物。随后,催化诱导邻近介导的多聚泛素化,最终让目标蛋白被蛋白酶体降解。这一技术在多种肿瘤治疗中大展身手,如在前列腺癌中,它能靶向降解雄激素受体(AR);在急性髓系白血病里,可对 BRD4 发起 “攻击”;对于乳腺癌患者,还能精准打击雌激素受体(ER)并展现出显著的疗效。目前,像ARV- 110(靶向 AR)和 ARV-471(靶向 ER)等极具前景的 PROTAC 分子已顺利进入临床试验阶段。不过,这些 “明星分子” 主要针对的是细胞内蛋白的泛素化和降解。
细胞表面膜和细胞外蛋白占编码蛋白的40%,在神经退行性疾病、自身免疫性疾病和症中起着至关重要的作用。如果能把它们当作降解靶点,那无疑是找到了攻克这些疾病的 “金钥匙”。Carolyn R. Bertozzi课题组率先开发了溶酶体靶向嵌合体(LYTACs),该技术通过糖基化抗体桥接目标蛋白胞外结构域与阳离子非依赖性甘露糖-6-磷酸受体(CI-M6PR,又称IGF2R, 粒曼可提供该基因敲除)或去唾液酸糖蛋白受体(ASGPR),诱导溶酶体转运和降解。随后,细胞因子受体靶向嵌合体(KineTACs)、整合素介导的溶酶体降解以及树枝状 DNA 嵌合体等新平台接连涌现。这些新技术各显神通,细胞因子受体(CXCR7)、整合素和清道夫受体(SRs)等多种溶酶体靶向受体(LTRs),也能实现膜蛋白降解,不断壮大蛋白降解技术的 “武器库”。这些新型 LYTAC 降解剂虽然厉害,却也有 “软肋”。它们的效果严重依赖特定细胞表面 LTRs 的表达水平,而 LTRs 在不同细胞系里的表达差异巨大,在某些肿瘤中,LTRs 的表达水平还特别低。这限制了其临床应用。
跨膜受体的内吞和溶酶体穿梭功能由一系列分选信号基序介导,包括双亮氨酸分选信号和酪氨酸分选信号。已有研究团队将这一信号通过基因工程方法将CI-M6PR的双亮氨酸分选信号基序移植至抗体C端,诱导靶向蛋白内化和溶酶体介导的降解。酪氨酸分选信号(主要包括NPXY和YXXØ基序,其中X代表任意氨基酸,Ø代表疏水性氨基酸)在蛋白分选中具有广泛作用。研究发现YXXØ基序更常见于溶酶体蛋白组分的胞质尾部,如溶酶体相关膜蛋白家族成员(LAMP-1、LAMP-2a、LAMP-2b和LAMP-2c)以及四跨膜蛋白超家族成员CD63,后者以高效递送激活相关细胞表面抗原至溶酶体膜而著称。因此,研究者提出了一种膜蛋白降解策略:通过截取溶酶体相关膜蛋白家族成员LAMP-2a 中的YXXØ溶酶体分选多肽基序并将其设计为融合肽序列,利用简易地点击化学反应将融合肽与特异性识别靶蛋白的核酸适体高效连接得到的信号适配体嵌合体(SApt)。为验证该技术,作者选取靶向蛋白酪氨酸激酶7(PTK7)的Sgc8适配体、靶向间质-上皮转化因子(Met)的SL1适配体以及靶向核仁素(NCL)的AS1411适配体作为概念验证模型。研究结果表明,SApts能高效降解这些适配体靶向的关键蛋白,有效诱导肿瘤细胞凋亡和肿瘤抑制,展现了该方法在癌症治疗和未来临床应用中的潜力。
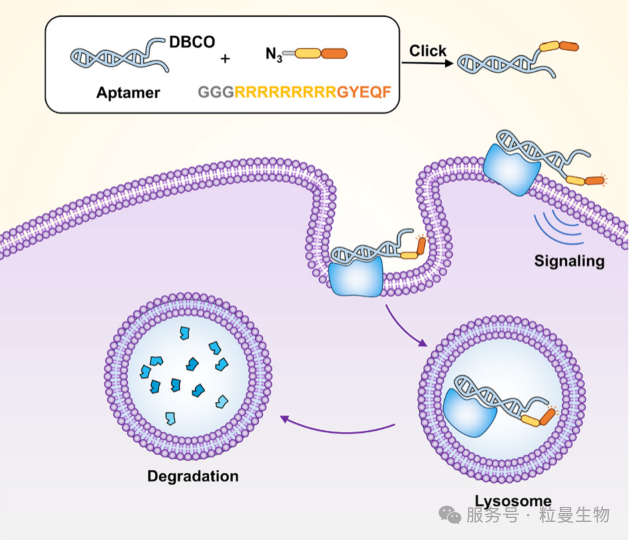
图2 溶酶体信号适体嵌合体 (SApt) 的工作概念膜蛋白的运输和降解
三、主要研究结果
3.1 基于分选信号基序的 P3 介导货物内化及溶酶体运输
溶酶体相关膜蛋白2(LAMP-2)的三种亚型 LAMP-2a、LAMP-2b 和 LAMP-2c 在病理生理过程和疾病中起关键作用,其 C 端胞质结构域均含高度保守的 YXXØ 基序。为验证研究思路,研究者们设计了基于 YXXØ 的肽段:从 LAMP-2a 获取五肽序列 GYEQF,与间隔序列 GGG 融合形成 P1;在 P1 的间隔序列与 YXXØ 基序间插入九精氨酸细胞穿透肽(CPP),构建增强膜穿透性的 P3。
实验中,将生物素标记的随机DNA 序列(RS)与 P1/P3 偶联,通过流式细胞术和共聚焦成像观察细胞内化情况。结果显示:P2 和 P3 显著促进荧光标记货物的内化,其中仅 P3 组出现溶酶体共定位,且内化效率呈时间依赖性。这表明分选信号基序需结合膜穿透机制才能介导货物内化及溶酶体运输,因此选择 P3 作进一步研究。
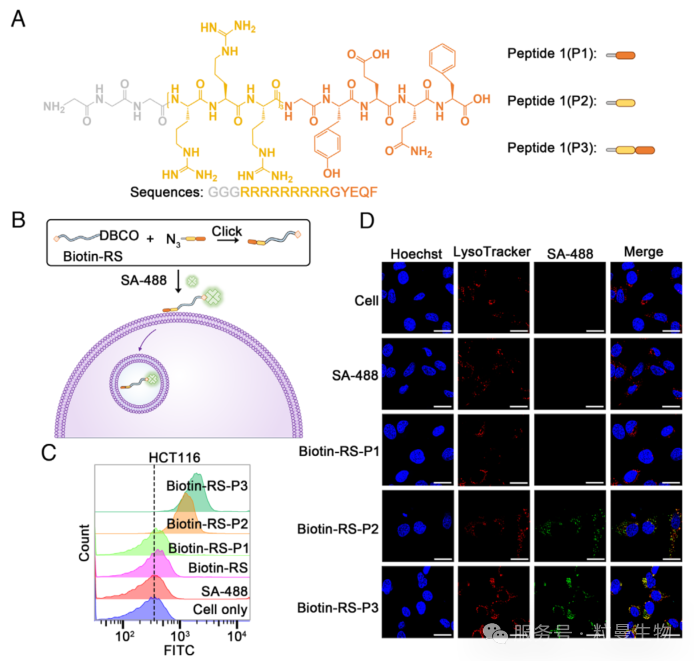
图3 通过分选信号基序介导的货物内化和转运到溶酶体的表征
3.2 SApt#Sgc8 介导细胞表面 PTK7 的高效降解
研究者们进一步探究基于YXXØ 的 P3 能否作为有效平台,实现细胞膜穿透并促进膜蛋白降解。跨膜蛋白酪氨酸激酶 7(PTK7)属于受体酪氨酸激酶家族的假激酶,与肿瘤发生和疾病进展密切相关。通过 TIMER 2.0 数据库分析发现,PTK7 在多种癌症中高表达。为此,选择 PTK7 作为模型靶点,以 Sgc8 适体为结合元件,通过点击反应将 P3 偶联至 DBCO 修饰的 Sgc8 3' 端,构建基于 P3 的 SApt#Sgc8 嵌合体。鉴于 PROTAC 接头长度对降解效率的重要性,在 Sgc8 与 P3 之间插入不同长度的腺嘌呤柔性接头。蛋白质免疫印迹实验显示,无腺嘌呤插入时(SApt#Sgc8-1.0)PTK7 降解效果最佳,且偶联 P3 后 Sgc8 的细胞结合能力略有增强。功能验证表明:500 nM SApt#Sgc8-1.0 处理 48 小时可耗竭约 70% 的 PTK7 蛋白,其半最大降解浓度(DC50)在 HCT116 和 A549 细胞中分别为 163.1 nM 和 589.9 nM。该降解具有特异性,不影响转铁蛋白受体 TfR1 的表达,且不改变 PTK7 的 mRNA 水平。流式细胞术和共聚焦成像均证实 PTK7 水平随处理时间呈依赖性下降(图3G)。进一步构建两端偶联 P3 的 SApt#Sgc8-2.0,其降解能力与 SApt#Sgc8-1.0 无显著差异。综上,SApt 平台可高效降解细胞表面 PTK7。
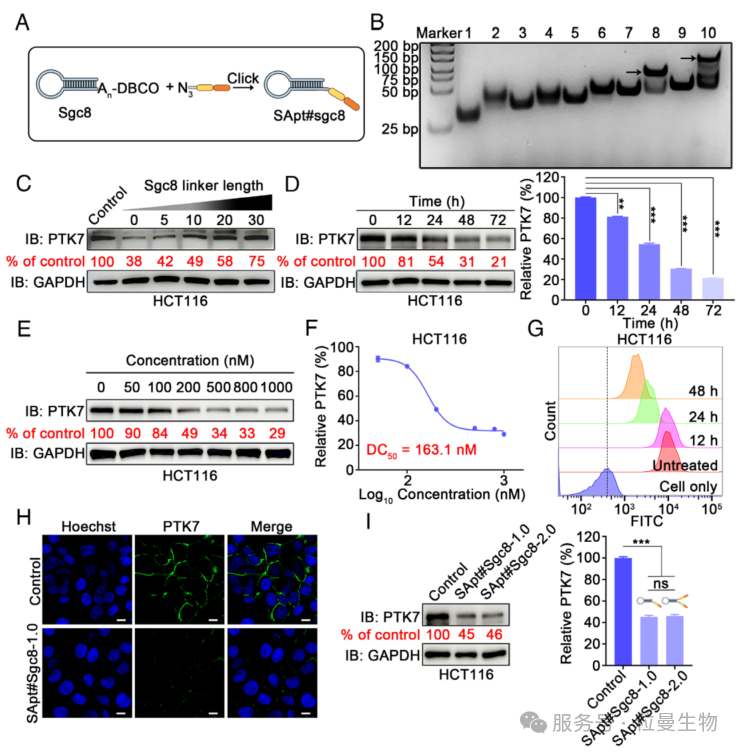
图4 SApt#Sgc8 促进细胞表面 PTK7 的有效降解
3.3 SApt 介导膜蛋白降解的分子机制
为探究SApt 降解膜蛋白的作用机制,研究者设计了 Sgc8 适体突变体(将第 13 位胞嘧啶替换为胸腺嘧啶),发现其与 HCT116 和 A549 细胞的结合亲和力显著减弱。功能实验显示,仅 SApt#Sgc8-1.0 能有效降低 PTK7 水平,而突变体 SApt#Sgc8 Mut 无降解作用,证实 PTK7 降解依赖于 Sgc8 与靶蛋白的结合。此外,将 Sgc8 与 P1、P2 或 P3 突变体(YXXØ 基序中酪氨酸突变为丙氨酸)偶联后,Western blot 结果表明:P1/P2 无法降解 PTK7,P3 的酪氨酸突变也会破坏其降解能力,说明 YXXØ 基序是关键功能元件。
内吞途径研究显示,网格蛋白介导内吞抑制剂Pitstop 2 和小窝蛋白介导内吞抑制剂 Nystatin 可阻断 PTK7 降解,而巨胞饮作用抑制剂 EIPA 无影响;溶酶体抑制剂巴佛洛霉素 A1 显著抑制降解,蛋白酶体抑制剂 MG132 则无作用,表明 SApt 通过网格蛋白 / 小窝蛋白介导的内吞作用,经溶酶体途径降解靶蛋白。值得注意的是,敲除 A549 细胞中的 IGF2R(常见 LYTAC 靶点受体)后,SApt 仍能有效降解 PTK7,提示其降解机制不依赖传统溶酶体靶向受体(LTRs)。因此,SApt 通过适体结合依赖、YXXØ 基序驱动的方式,利用网格蛋白/小窝蛋白介导的内吞-溶酶体途径实现膜蛋白降解,为不依赖 LTRs 的新型蛋白降解策略提供了理论依据。
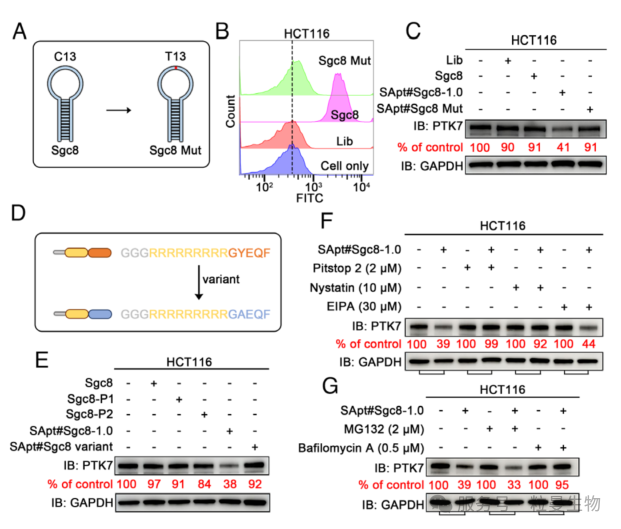
图5 SApt 介导的膜蛋白降解的机制研究
3.4 SApt 对下游通路及细胞生理的调控机制
为验证前期发现,研究者们通过定量蛋白质组学分析SApt#Sgc8-1.0 处理前后的细胞蛋白变化。与对照组相比,处理组中有 380 种蛋白表达上调、447 种蛋白下调,且 PTK7 水平显著降低(图 5A)。其中,Wnt 信号通路关键调控蛋白 Frizzled 6(FZD6)表达下调;而网格蛋白 / 小窝蛋白介导内吞相关蛋白(AP2A1、AP2M1、Caveolin)、囊泡运输蛋白(ATP6V0A1、ATP6V1H)及泛素化修饰蛋白(UBA1)等显著上调,逆转录复合物成员(VPS26A、SNX3)则表达下降(图 5B)。这些变化与 LYTAC 介导膜蛋白降解的细胞机制一致,也印证了内吞抑制剂实验的结论。透射电镜观察显示,SApt#Sgc8-1.0 处理后细胞内溶酶体相关细胞器数量增加, cargo 运输活动增强(图5C)。
在细胞功能研究中,CCK-8 实验表明:SApt#Sgc8-1.0 对肿瘤细胞增殖的抑制作用显著强于单纯 Sgc8 或突变体 SApt#Sgc8 Mut,且对 PTK7 阴性的 Ramos 细胞无抑制效果(图 5D)。流式细胞术及共聚焦成像显示,500 nM SApt#Sgc8-1.0 处理 96 小时后,细胞凋亡水平显著升高(图 5E-F)。综上,SApt 通过促进细胞膜-溶酶体运输降解 PTK7,进而抑制细胞增殖、调控下游信号通路并诱导细胞凋亡。
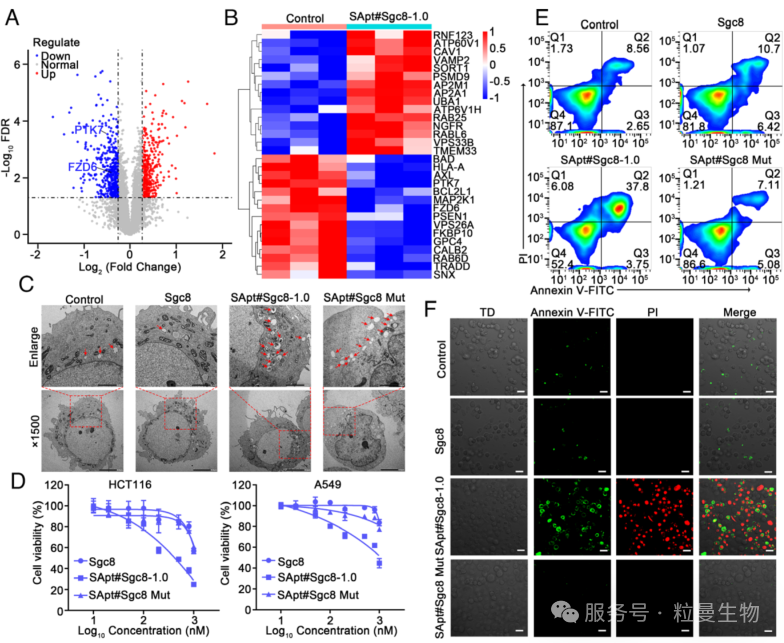
图6 SApt 诱导的下游途径和细胞生理学的调节
3.5 SApt 平台增强抗肿瘤功效
基于前期研究,研究者们通过荷瘤小鼠模型评估SApt 平台的体内应用潜力。将 Cy5 标记的Sgc8或SApt#Sgc8-1.0 注射到HCT116肿瘤的裸鼠体内,活体成像显示 SApt#Sgc8-1.0 具有更强的肿瘤富集能力和更长的滞留时间。治疗实验中,荷瘤小鼠被分为五组(DPBS、Sgc8 静脉/瘤内注射、SApt#Sgc8-1.0 静脉/瘤内注射)。当肿瘤体积达 50 mm³ 时开始给药,结果显示:SApt#Sgc8-1.0 显著抑制肿瘤生长,其中瘤内注射组效果最优(图 6A-D)。肿瘤组织 Western blot 证实 SApt#Sgc8-1.0 组 PTK7 蛋白水平显著降低(图 6E);免疫组化显示 PTK7 信号减弱、增殖标志物 Ki67 表达增强,表明 PTK7 降解可抑制肿瘤增殖(图6F)。此外,各组小鼠体重及主要器官(心、肝、脾、肺、肾)HE 染色均未见明显异常,证实 SApt 平台的体内安全性(图 6G)。综上,SApt 平台在体内展现出高效的肿瘤抑制能力,为靶向膜蛋白的抗肿瘤治疗提供了新策略。
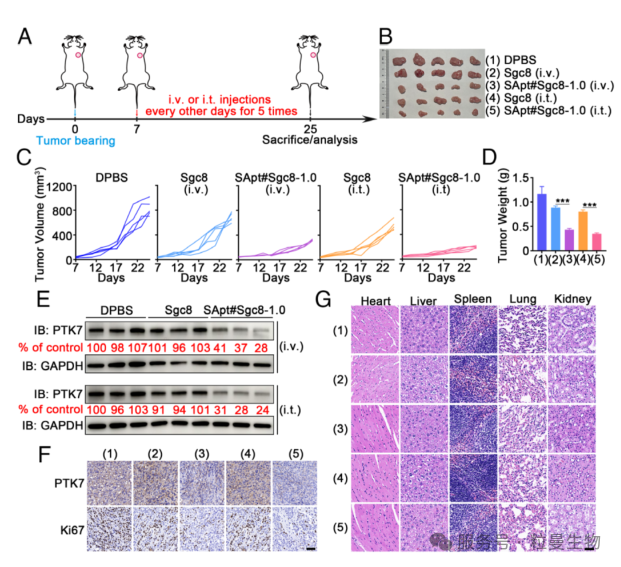
图7 SApt 介导的 PTK7 降解诱导强大的肿瘤抑制
3.6 SApt 平台实现不同适体靶向致病蛋白的高效降解
为拓展SApt 平台的靶点范围,研究者们选取与病理状态高度相关的跨膜蛋白 Met 因子和核仁素(NCL)作为新靶点,分别采用 SL1 和 AS1411 适体进行研究。流式细胞术验证了 SL1/AS1411 与对应细胞系的结合能力后,将 P3 偶联至适体 3' 端,成功构建 SApt#SL1 和 SApt#AS1411(图 7A、E)。功能实验显示:SApt#SL1 可时间依赖性降解 HeLa 和 A549 细胞中的 Met 蛋白,其半最大降解浓度(DC50)在 HeLa 细胞中为 198.6 nM,A549 细胞中为 438.8 nM(图 7B-D);SApt#AS1411 在 72 小时内可耗竭 MCF-7 细胞中约 60% 的 NCL,DC50 为 415.6 nM(MDA-MB-231 细胞中为 462.9 nM)(图 7F-H)。当构建结合力减弱的适体突变体(SApt#SL1 Mut/SApt#AS1411 Mut)后,蛋白降解能力显著丧失,证实降解依赖于适体与靶点的结合。值得注意的是,SApt#AS1411 可同时降解 MCF-7 细胞(核定位为主)和 MDA-MB-231 细胞(胞质定位为主)中的 NCL。活细胞成像显示,FAM 标记的 SApt#AS1411 可进入细胞核,而核质运输抑制剂 leptomycin B 能显著抑制 NCL 降解(见SI),提示其降解机制与 NCL 的核 - 质穿梭特性及 P3 的细胞穿透能力相关。
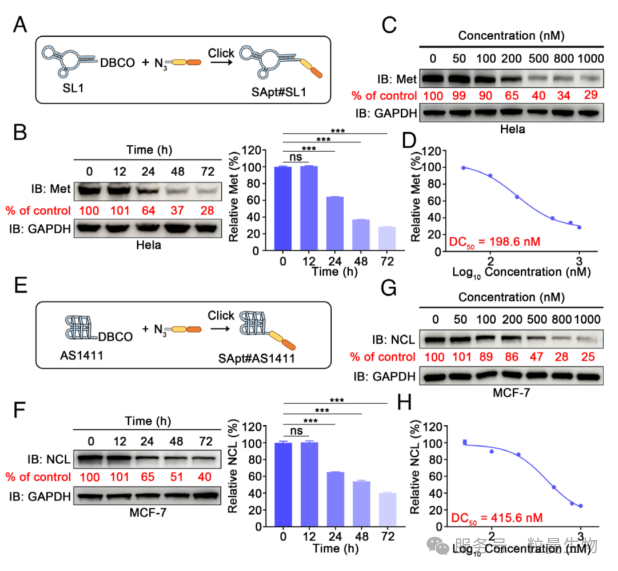
图8 SApt 平台与不同适配体偶联ERS 降解其他膜蛋白
四、结论
细胞膜蛋白作为细胞间及细胞外信号传导的媒介,在多种疾病中常过度表达,是重要治疗靶点。LYTAC 技术虽为 “不可成药” 蛋白降解提供了新思路,但其高度依赖溶酶体靶向受体(LTRs)且抗体等结合模块获取困难,严重制约临床应用。本研究开发了 SApt(适体-溶酶体分选信号嵌合体)平台:通过点击化学反应将适体与 LAMP-2a 来源的 YXXØ 溶酶体分选信号偶联,利用适体特异性识别靶蛋白,引导分选信号触发溶酶体运输与降解。系统研究表明,SApt 通过内吞-溶酶体途径、依赖信号肽高效降解多种适体靶向的疾病相关蛋白。体内实验证实,SApt 显著抑制肿瘤生长且无体重异常或器官功能损伤。该平台突破了 LYTAC 的LTR依赖瓶颈,为靶向膜蛋白及细胞内蛋白的降解提供了高效、安全的新策略,在临床精准治疗中具有广泛应用前景。
参考文献
W. Xie, W. Sun, Q. Li, Y. Dang, L. Ma, Y. Liu, H. Zhang, F. Qu, & W. Tan, Click-constructed modular signal aptamer chimeras enable receptor-independent degradation of membrane proteins, Proc. Natl. Acad. Sci. U.S.A. 122 (21) e2424500122, https://doi.org/10.1073/pnas.2424500122 (2025).
2025 /
06-30
所属分类:
公司新闻
相关资讯—
2025-08-12
2025-08-12
2025-08-12


