问题解读 | 粒曼如何定义“行业交付标准”:何为成功的基因敲除细胞?
2025-08-12
背景资料
问题解读 | 细胞基因敲除后的验证问题来源于实验技术操作还是科研试剂行业?
我们在上一期问题解读(细胞基因敲除后的验证问题来源于实验技术操作还是科研试剂行业?)中留下以下问题:“何为成功的基因敲除?何为成功的WB实验,成功的WB实验就能代表成功的基因敲除吗?”,本期问题解读,我们试图将该问题解析清楚。
基因敲除是通过改变特定基因的DNA序列使其失去功能,以研究基因在生物体中的作用。基因敲除(KO)细胞在药物靶点发现、基因功能研究、抗体特异性验证等领域具有广泛应用。基因敲除细胞系的验证主要从基因水平及蛋白表达水平进行鉴定。达到什么标准是可用的KO细胞呢?
1. 基因水平敲除成功判定标准
在敲除区域的上下游设计引物扩增目标基因,通过测序比对野生型细胞及敲除细胞的测序结果,来判定是否存在目标位点(sgRNA识别位点)敲除。目前的测序方式可以用Sanger一代测序,近几年NGS二代测序甚至三代测序越来越多的用于基因敲除的基因水平验证环节。
(参考阅读:LM NGMS验证平台: 粒曼“NGS二代测序+MS蛋白质谱”双重验证体系,从“根”上解决细胞基因敲除验证问题,完美绕开抗体行业问题:让“抗体”再跑一会儿~
问题解读 | 细胞基因敲除后的验证问题来源于实验技术操作还是科研试剂行业?)

图1 引物设计原理图
1.1 KO细胞池(系)敲除效率分析
CRISPR/Cas9技术介导的基因敲除具有随机性,Cas9蛋白的随机切割及细胞体内非同源末端修复(NHEJ)会导致基因型的多样性。由于PCR产物是混合物,会导致测序结果的套峰或杂峰(如图2)。利用粒曼生物专有软件,可分析出基因敲除效率及对应的基因型。
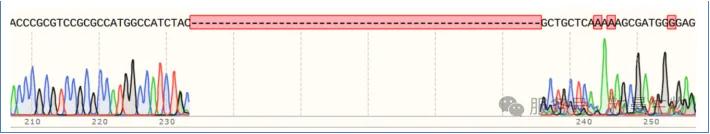
图2 Sanger测序结果(多种基因型)
1.2 什么样的基因型对应成功的敲除细胞呢?
(1)对于KO多克隆细胞来说,粒曼团队目前制定的基因水平敲除效率的交付标准是70%以上(远高于行业水平),即:敲除细胞池中有70%以上比例是成功编辑的细胞,多克隆细胞测序结果一般都是套峰或杂峰。
(2)对于KO单克隆细胞来说,成功的敲除单克隆细胞,通常分成2种:基因敲除纯合子和杂合子。
A. 纯合子的敲除效率就是100%,即该基因的所有等位基因都发生了编辑,不存在野生型的基因型(此处特别需要提醒:有的客户认为所有等位基因发生完全相同的编辑(片段丢失或者移码突变),才认为是纯合子,粒曼团队称此为“理想单克隆”,我们认为这种情况的发生概率是比较低的,也不应成为学术和行业的唯一交付标准,这往往会导致在目前技术水平下的资源过度浪费)。同时测序基因型清晰,基因型数量和该基因拷贝数对应,根据基因拷贝数的不同,可能出现1种、2种或多种基因型,对应的测序峰图也会出现套峰或杂峰。
B. 另一种是杂合子,针对某些必需性高的基因,敲除后会影响细胞生长,往往难以获得纯合子,敲除效率一般在50%左右(针对二倍体细胞),即有1个等位基因敲除另外一个等位基因未编辑。
1.3 缺失片段长度分析
一个成功的敲除细胞,往往行业内认同以下标准:
(1)每一种基因型都应该是非三倍数插入或缺失,如果KO细胞对应碱基序列出现非三倍数的插入或缺失,就会导致后续阅读框发生移码,从而达到目标蛋白敲除的效果。
(2)如果是基因大片段的缺失,通常不要求非三倍数的缺失,一般认为:当缺失片段超过20bp以上时,会引起转录失败或mRNA的降解,导致蛋白无法正常翻译。

图3 基因敲除导致蛋白翻译终止
1.4 基因敲除位置分析
在设计sgRNA切割位置时,需要结合转录本、外显子及基因功能区等三大因素。有些基因存在多个转录本,成功的基因敲除应该是在转录本共有区,如果只敲除了其中的某些转录本,可能导致未变化的转录本仍能表达正常蛋白,无法达到完全敲除的目的。
粒曼团队选择早期外显子的设计策略是基于以下考虑:
(1)基因在早期外显子的敲除往往影响整个基因后续的转录翻译。
(2)当早期外显子不是共有转录本区域时,我们可以根据基因功能区的位置来选择敲除。
因此,如果敲除位置同时满足转录本共有区域(条件一)、早期外显子(条件二)及基因功能区(条件三)则为理想的敲除位置。但并不是所有靶基因的敲除位置可以同时满足上述三个条件,可以结合蛋白水平的验证情况及功能验证的结果来确认。

图4 基因存在多个转录本
总之,结合敲除效率分析、基因缺失片段大小及敲除位置等因素,我们对基因型成功敲除细胞的判定总结如下表。
|
细胞类型 |
基因型 |
敲除效率 |
敲除位置 |
是否可用 |
|
多克隆 |
多种基因型 |
低于70% |
/ |
可用,但建议铺单克隆(粒曼内部质控要求不通过) |
|
多克隆 |
多种基因型 |
高于70% |
满足其中1种或2种 |
结合蛋白水平或功能验证结果判断 |
|
3个条件都满足 |
可用 |
|||
|
单克隆 |
存在WT序列的杂合子 |
50%左右(针对二倍体) |
满足其中1种或2种 |
如果基因为必需基因,结合其他验证实验判断。如果基因为非必需基因,不建议使用 |
|
3个条件都满足 |
如果基因为必需基因,结合其他验证实验判断。如果基因为非必需基因,不建议使用 |
|||
|
单克隆 |
复杂基因型纯合子 |
100% |
满足其中1种或2种 |
结合蛋白水平或功能验证结果判断 |
|
3个条件都满足 |
可正常使用 |
|||
|
单克隆 |
单一基因型纯合子 |
100% |
满足其中1种或2种 |
结合蛋白水平或功能验证结果判断 |
|
3个条件都满足 |
理想单克隆 |
表1 细胞基因型鉴定结果判定
2. 蛋白水平敲除成功判定标准
目前针对基因敲除细胞蛋白水平验证的方法主要有两种:Western Blot(WB)检测及蛋白质谱检测,二者各有优势及局限性。
2.1 WB检测验证
理论上基因水平成功敲除后,靶蛋白肯定会受到影响,WB显示KO组目标蛋白含量明显变化,说明蛋白水平敲除成功。如下图5(B)。但是,如果在基因水平达到质量标准的情况下,WB并未检测到KO组目标蛋白的变化,是否说明未敲除成功呢?答案是否定的,WB结果极大的依赖抗体的表位情况(目前全球科研抗体行业,并没有将单克隆抗体的抗原表位鉴定作为标准的质控标准)以及质量(尤其是抗体特异性问题),据Baker M. (2016)《Nature》统计,超70%的生物学家无法重复他人的实验结果,超50%无法重复自己的实验结果,其中抗体相关研究一直存在严重的“重现危机”。我们看下面的示例,相同的敲除细胞系,用不同的抗体检测出来的结果有明显差异。WB验证实验强烈建议使用KO验证抗体,避免由于抗体特异性问题导致的验证不准确。
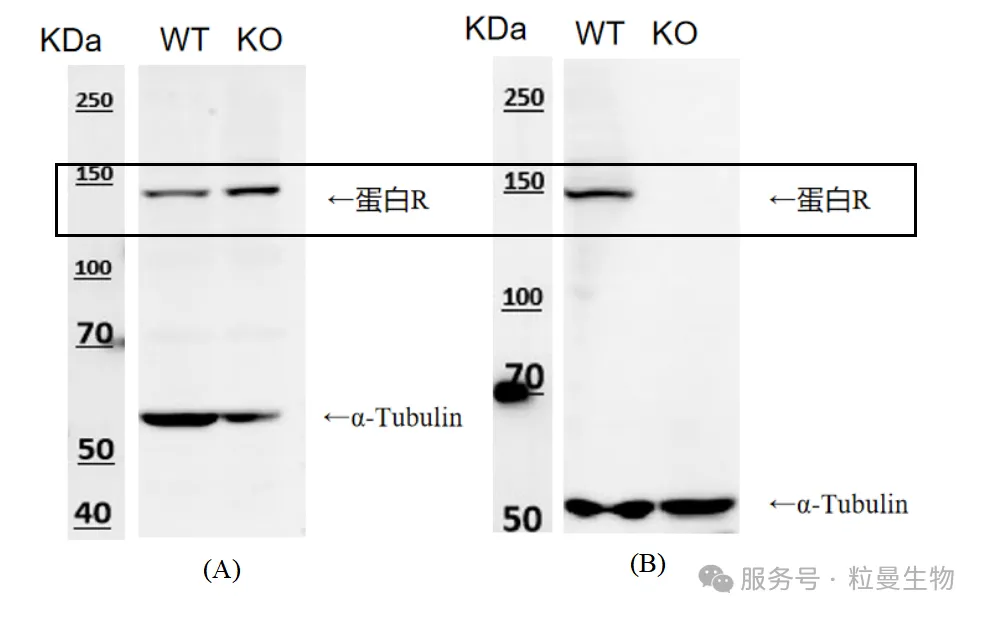
图5 不同抗体针对同一个KO细胞WB结果
2.2 蛋白质谱验证
WB试验受限于抗体质量,而蛋白质谱验证可以很好的排除这一问题,质谱验证是将WT及KO细胞的全蛋白进行质谱检测,根据检测到的目标蛋白丰度,可以判断敲除细胞是否成功,同时质谱采集到的肽段信息也能直观地展示出缺失的氨基酸序列(其多肽的信息显著多于抗体的表位多肽信息)。此外还可以进一步分析敲除后蛋白的相互作用信息。
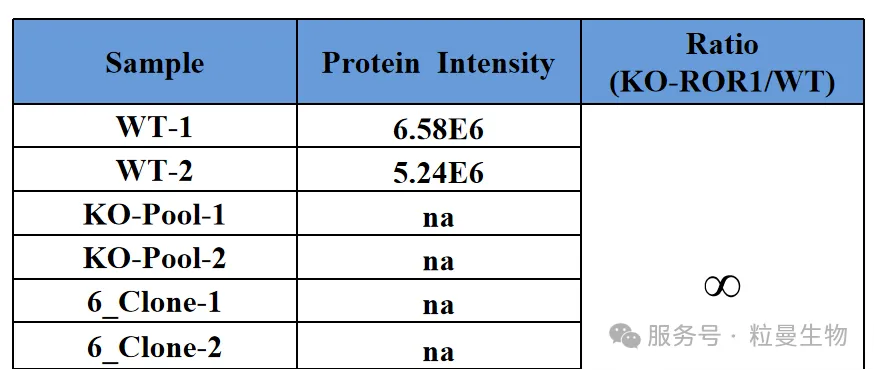
图6 敲除细胞质谱验证结果
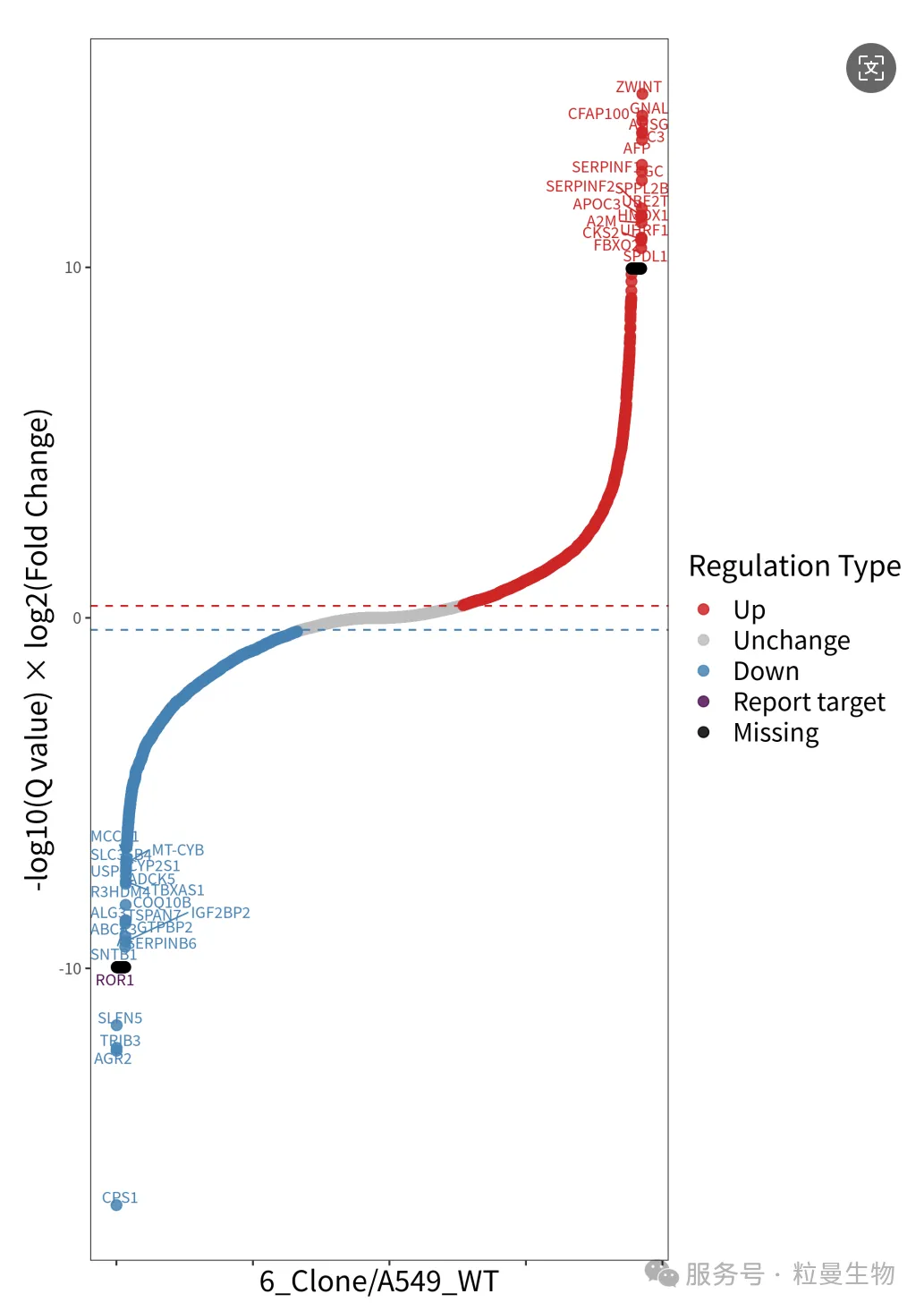
图7 质谱验证KO细胞的肽段差异及相互作用蛋白情况
总之,结合基因的表达水平、蛋白类型(膜蛋白/胞内蛋白)、抗体的类型(单抗/多抗)、厂家(进口/国产/品牌)、质量(KO验证/无)等众多因素,我们对蛋白水平成功敲除细胞的判定总结如下表。
|
细胞类型 |
蛋白水平 |
是否可用 |
|
多克隆KO效率低于70% |
WB验证或质谱验证有一项成功 |
可用,需结合后续的实验目的综合评估 |
|
多克隆KO效率高于70% |
WB验证或质谱验证有一项成功 |
可用 |
|
WB验证和质谱验证都不成功 |
不可用,可以考虑挑单克隆 |
|
|
单克隆杂合子(50%) |
WB验证或质谱验证有一项成功 |
可用 |
|
WB验证和质谱验证都不成功 |
不可用,结合基因水平结果分析 |
|
|
单克隆纯合子(多基因型)敲除效率100% |
WB验证或质谱验证有一项成功 |
可用 |
|
WB验证和质谱验证都不成功 |
需要结合其他功能实验来判断 |
|
|
单克隆纯合子(单一基因型)敲除效率100% |
WB验证或质谱验证有一项成功 |
可用 |
|
WB验证和质谱验证都不成功 |
需要结合其他功能实验来判断 |
表2 蛋白水平验证结果判定
3. 结合基因水平和蛋白水平综合判定敲除成功
粒曼针对不同的敲除细胞类型,结合基因和蛋白水平综合评估敲除标准。目前该标准被“杞梓认证”质量标准体系纳入其中,并推进在行业内标准的实施与推广。
(1)敲除效率低的敲除细胞池(KO Cell Pool):即发生编辑的细胞在整个细胞池中的占比低,从粒曼团队的项目经验来看,基因水平检测到KO效率低于70%的Pool较难在蛋白水平检测到敲除。建议对Pool进行单克隆分选,挑选KO效率高的单克隆进行后续功能实验。
(2)敲除效率高的KO Cell Pool:即发生编辑的细胞在整个细胞池中的占比高于70%,这种KO Pool大概率能在蛋白水平表现出敲除,对于早期药物发现或抗体验证等很多应用场景下是可用的。
推荐阅读:杞梓基金|粒曼基因敲除细胞池定制-28天全面加速科研进程!
(3)KO单克隆杂合子:即KO单克隆细胞中,靶点某些等位基因存在WT序列,其他等位基因为KO移码基因型,表现出的KO效率一般为50%左右。这种单克隆杂合子一般不推荐使用,可以在这个单克隆杂合子基础上进行第二次电转,以达到100%敲除效率。但是有些基因由于必需性高(即完全敲除会影响细胞的生长甚至死亡)无法拿到100%敲除的细胞,如果杂合KO能检测到表型的变化,可以用于后续研究。
(4)KO复杂基因型纯合子:即为广义的“KO纯合子”,即靶基因100%敲除,但不同等位基因发生编辑的位点及序列有差异,只要每种基因型都是移码KO或大片段缺失,则属于可以正常使用的KO单克隆。
(5)KO单一基因型纯合子:即靶基因全部为KO移码或大片段缺失基因型,且基因型完全一致,这是最理想的基因型,大概率能在蛋白水平检测到敲除,如果出现不理想的蛋白水平验证结果,往往考虑抗体质量的问题。
(6)蛋白水平验证成功,但基因水平未验证成功的KO单克隆:对于WB或质谱验证有敲除,但是基因水平未敲除成功的细胞,我们的建议是不要轻易使用,这种情况可能是由于脱靶导致的,例如本来是设计在3号外显子敲除,但是由于脱靶效应导致该基因其他外显子敲除引起蛋白水平变化,这种情况需要格外注意,sgRNA有可能脱靶影响其他基因的功能,导致细胞的功能验证实验结果不准确。
(7)WB验证成功,基因敲除效率100%,但敲除位置不在基因功能区(慎重选择):基因敲除细胞作为基因功能研究课题中的重要工具,但在发表论文时往往要求有WB验证的结果,可是,很多时候行业内存在的所有可采购的抗体或者自行制备的抗体特异性很难满足实验要求,在此情况下我们根据抗体的表位(该位置不在基因功能区域)来个性化设计敲除位置,拿到这种敲除细胞后,需要重点的关注蛋白功能的影响。
总结
基因敲除细胞系(基因+蛋白水平全验证)作为新药研发及基础科研领域的基本实验材料,被越来越多地用于各大研究领域,作为不可或缺的证据,用于学术研究结论的重要支撑。这个看似“简单”的实验材料,却面对着几个行业、不同技术领域的相互“拉扯”,在这种拉扯中终将慢慢“尘埃落定”!
我们从CRISPR/Cas9技术的发展历程,质粒和慢病毒递送以及目前主流的RNP法递送,从单一sgRNA的使用到目前主流的2-3条sgRNA混合使用,伴随着敲除方法的进化、敲除策略的优化以及敲除效率的提升等改进,在敲除验证上,尤其是蛋白水平上,受制于科研抗体行业的发展。
粒曼团队相信,不论是学术团队还是试剂行业,越来越重视专业水平和质量稳定性,将在未来的3-5年内出现更加有影响力的国内外品牌,重视“科学”,深耕“技术”,让科学与技术相辅相成,共同促进。
上一页:
2025 /
08-12
所属分类:
公司新闻
相关资讯—
2025-08-12
2025-08-12
2025-08-12


