踵事增华 | Cumate诱导过表达技术,蛋白表达调控又添“新利器”【收藏】
2025-09-24
在诱导过表达技术领域,四环素调控系统(Tet-On/Tet-Off)、蜕皮激素类似物调控系统(EcR)已广泛应用,但科研需求的不断升级,催生了更具优势的新技术。Cumate 诱导过表达技术凭借低背景、高诱导效率、无细胞毒性等特点,近年在《Nucleic Acids Research》《Biotechnology and Bioengineering》等权威期刊文献中频繁亮相,成为细胞生物学、基因治疗、药物研发等领域的 “新宠儿”。
-
阻遏蛋白(CymR):由cymR 基因编码,天然状态下可特异性结合到靶启动子的操作序列(CuO)上,抑制下游目标基因的表达,就像给基因装上了 “刹车”。 -
诱导剂(Cumate):即对异丙基苯甲酸,是一种小分子化合物,性质稳定且无细胞毒性。它能与阻遏蛋白CymR特异性结合,使其构象发生改变,失去与CuO序列结合的能力,相当于松开 “刹车”。 -
靶启动子(如PCuO-CMVmin):由CuO操作序列和最小 CMV 启动子(CMVmin)组成。无Cumate时,CymR结合CuO序列,CMVmin无法启动转录;加入Cumate后,CymR脱离CuO序列,CMVmin被激活,驱动下游目标基因高效表达。
-
第一步:关闭状态:无Cumate存在时,阻遏蛋白CymR牢固结合在靶启动子的CuO序列上,RNA 聚合酶无法结合到 CMVmin 启动子上,目标基因处于 “沉默” 状态,背景表达极低(文献数据显示,背景表达量仅为组成型启动子的 1% 以下)。
-
第二部:开启状态:当加入一定浓度的 Cumate后,Cumate快速与 CymR 结合,导致 CymR 构象改变并从 CuO 序列上解离。此时,CMVmin 启动子恢复活性,RNA 聚合酶顺利结合并启动转录,目标基因在数小时内即可实现高效表达,且表达水平随Cumate浓度升高呈剂量依赖性增加(在一定浓度范围内)。(如图1)
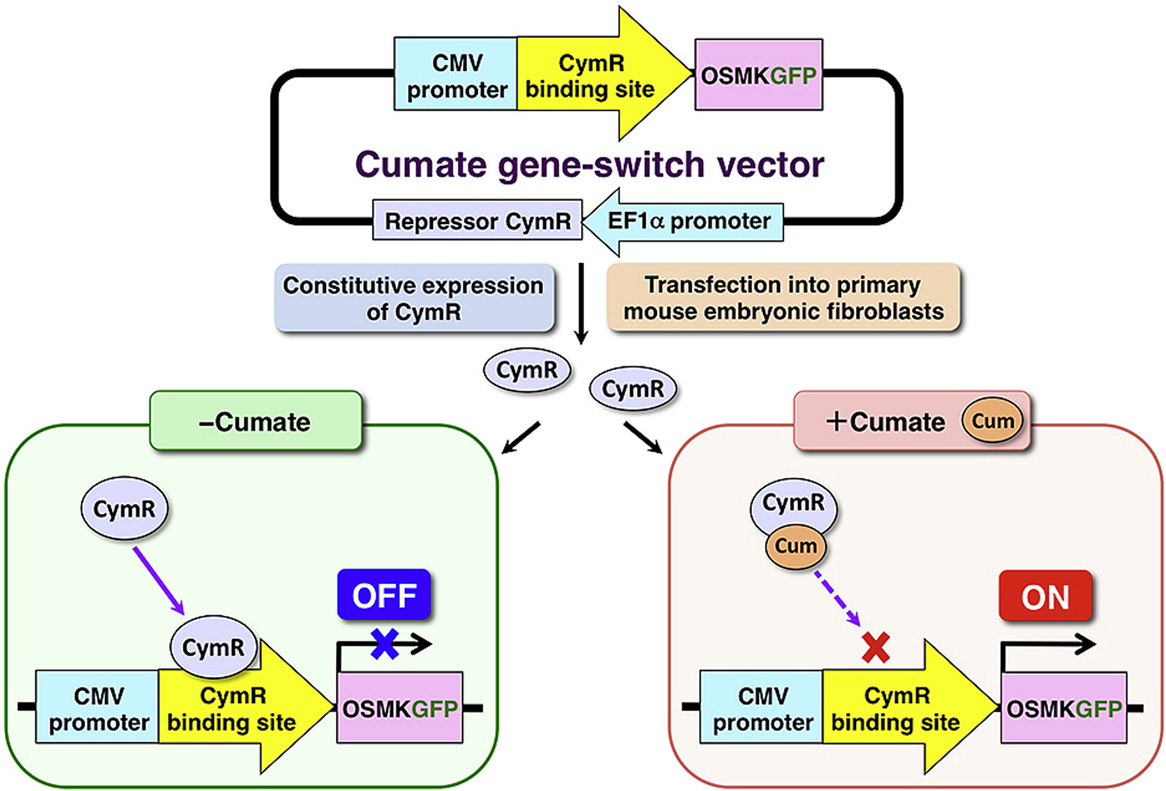
图1 Cumate调控过程
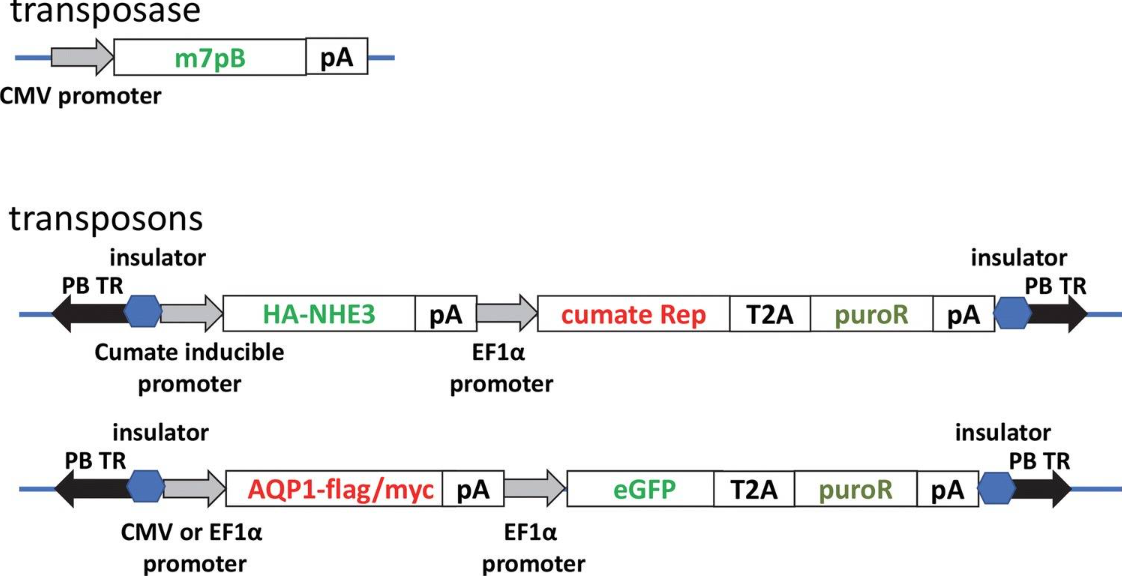
图2 Cumate系统构建肾上皮细胞过表达 NHE3细胞系
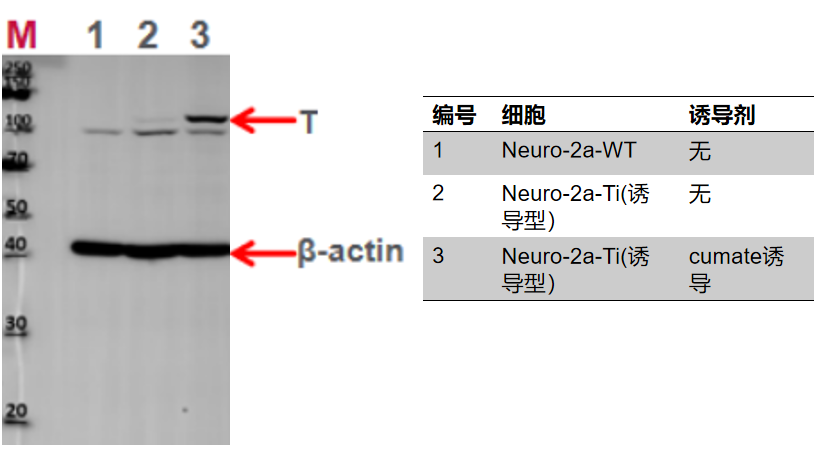
图3
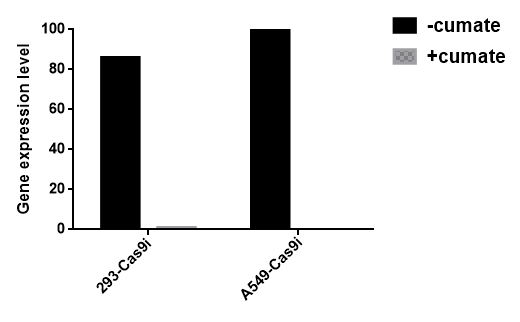
图4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2025 /
09-24
所属分类:
公司新闻
相关资讯—
2025-12-22
2025-12-22
2025-12-22

