在肿瘤研究领域,A549 细胞(人非小细胞肺癌细胞)是出镜率极高的明星模型;而 ADAR 基因(RNA 腺苷脱氨酶)作为调控 RNA 编辑的核心分子,近年来在肿瘤发生发展中的作用逐渐浮出水面。当 A549 细胞遇上 ADAR 点突变,会碰撞出怎样的科研火花?今天就带大家读懂这个特色细胞系的价值,为你的肿瘤研究提供新灵感。
一、ADAR 蛋白功能:RNA 编辑的 “分子裁缝”,肿瘤调控中的 “双面角色”
ADAR(Adenosine Deaminase Acting on RNA,RNA 腺苷脱氨酶)是一类专门作用于 RNA 的酶,其核心作用是将 RNA 分子中的腺苷(A)脱氨基转化为肌苷(I),这一过程被称为“A-to-I RNA 编辑”。由于肌苷(I)在翻译时会被核糖体识别为鸟苷(G),相当于给 RNA换了个密码,进而从多个层面调控基因表达。
ADAR 蛋白的核心功能可分为 4 类:
当A-to-I 编辑发生在mRNA 编码区(CDS) 时,会直接改变密码子,导致翻译出的氨基酸发生变化,进而影响蛋白的结构、活性或稳定性。典型例子:神经细胞中,ADAR2 会编辑谷氨酸受体(GluR2)mRNA 的 Q/R 位点,将谷氨酰胺(Q)密码子(CAG)编辑为精氨酸(R)密码子(CIG),使 GluR2 受体失去钙离子通透性,避免神经细胞过度兴奋导致的损伤;在肺癌、肝癌细胞中,ADAR1 会编辑抑癌基因TP53的 mRNA,改变其编码的氨基酸序列,导致 p53 蛋白失去 “抑制肿瘤增殖” 的功能,相当于给肿瘤细胞 “松了刹车”。
A-to-I 编辑更多发生在 RNA 的非编码区(如 3'UTR、内含子、lncRNA),这些区域的编辑虽不改变蛋白序列,却能通过影响 RNA 与其他分子的结合,调控 RNA 的稳定性或定位。mRNA 的 3'UTR 区域常存在 microRNA(miRNA)的结合位点,ADAR 编辑可破坏或创建 miRNA 结合位点,若编辑破坏了 miRNA 的结合位点,mRNA 就不会miRNA 介导降解,稳定性增强;反之则加速降解;肿瘤案例:乳腺癌细胞中,ADAR1 编辑MMP9(基质金属蛋白酶 9,促进肿瘤侵袭)mRNA 的 3'UTR,破坏了 miR-29 的结合位点,导致MMP9 mRNA 半衰期延长、蛋白表达升高,进而增强肿瘤细胞的侵袭能力。
3. 调控非编码 RNA 功能:解锁 lncRNA、circRNA 的 “隐藏作用”
除了mRNA,ADAR 还能编辑长链非编码 RNA(lncRNA)、环状 RNA(circRNA) 等非编码 RNA,通过改变其二级结构或与蛋白 / RNA 的相互作用,调控其功能。例如:lncRNA NEAT1是形成核 paraspeckle 结构的关键分子,ADAR1 对NEAT1的编辑会破坏其二级结构,导致 paraspeckle 结构解体,进而影响细胞应激反应;在结肠癌中,ADAR1 对NEAT1的过度编辑会促进肿瘤细胞耐受氧化应激,帮助其存活。
作为天然免疫的“防线” 之一,ADAR 蛋白能识别并编辑病毒 RNA(如 HIV、HCV、流感病毒 RNA),通过破坏病毒基因组的完整性或病毒蛋白的编码序列,抑制病毒复制。病毒 RNA 通常具有大量双链区域(dsRNA),而 ADAR 蛋白对 dsRNA 的亲和力极高,会优先编辑这些区域,导致病毒基因发生突变,无法正常合成功能蛋白;部分肿瘤细胞会 “劫持” ADAR 的抗病毒功能比如 EB 病毒(与鼻咽癌、淋巴瘤相关)感染的细胞中,ADAR1 会被病毒激活,反而通过编辑病毒 RNA 帮助病毒 “逃避免疫系统”,同时也为肿瘤细胞提供了 “免疫庇护”。
ADAR1基因(位于1q21.3)突变是导致DSH的主要原因,该疾病表现为肢端对称性色素沉着与减退斑。研究发现多个新突变位点:
-
错义突变:p.R1155W、p.K1105N、p.G1047A、p.F1099L、p.G1068R等
-
框移突变:1605delT(p.F535fs)、c.1970dupT(p.F657fs)、c.2433_2434delAG(p.T811fs)
-
无义突变:c.1630C>T(p.R544x)、p.R1096x
中国人群研究显示,ADAR1基因突变热点可能位于外显子9-15,且以杂合突变为主。这些突变导致RNA编辑功能障碍,影响黑素母细胞分化,产生高活性及低活性两种黑素细胞,从而形成色素异常。
2. Aicardi-Goutières综合征(AGS)相关突变
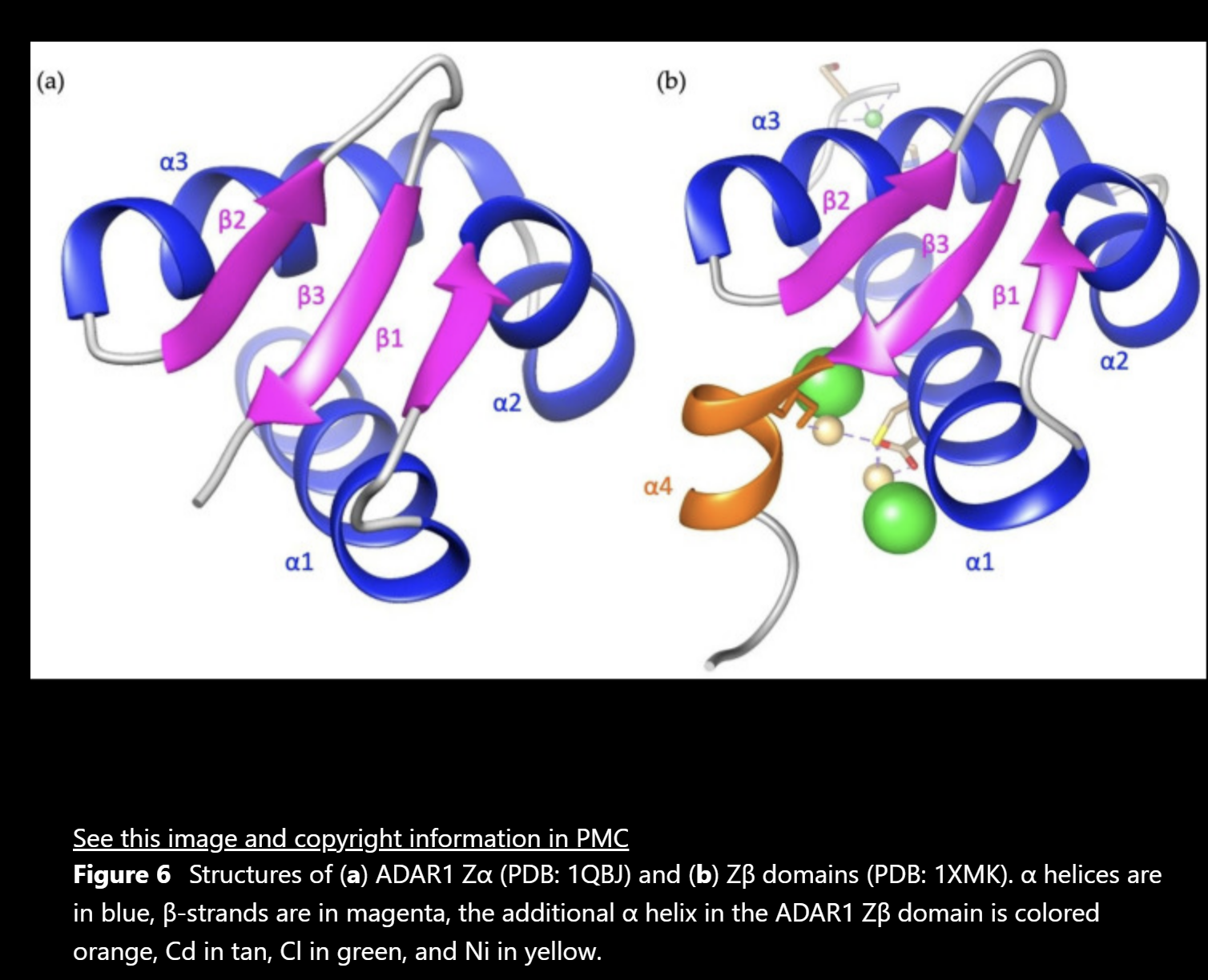
ADAR1的Zα结构域点突变与AGS相关,如G1007R、R892H、K999N等。机制研究表明:
-
G1007R位于二聚化界面,导致二聚体解离及碱基翻转受阻,完全丧失编辑活性
-
A870T和K999N突变选择性损害短双链RNA(<10bp)的编辑能力
这些突变导致内源性Alu元件"免疫屏蔽"失效,异常激活干扰素信号通路
-
R767突变:位于dsRNA相互作用结构域,影响蛋白质稳定性,破坏与dsRNA的相互作用
-
表达异常:在肝癌、肺癌等癌症中高表达,通过编辑癌基因和抑癌基因RNA影响肿瘤生长转移
-
免疫逃逸:ADAR1过表达使癌细胞逃避宿主先天免疫反应,与免疫检查点抑制剂耐药相关
三、为什么选A549 细胞做 ADAR 点突变?它的肿瘤特性太 “适配” 了!
A549 细胞是从人肺腺癌患者中分离建立的细胞系,作为非小细胞肺癌(NSCLC)的经典模型,它的特性与 ADAR 的肿瘤调控功能高度契合,简直是 “天生一对”:
1. ADAR1 在 A549 中高表达,与临床肿瘤特征一致
多篇文献(如Oncogene 2020 年研究)证实,A549 细胞中 ADAR1 的 mRNA 和蛋白水平显著高于正常肺上皮细胞,且这种高表达与 NSCLC 患者的肿瘤分期、淋巴结转移正相关。用 A549 做 ADAR 点突变,能模拟临床肿瘤的真实分子背景,研究结果更具临床转化价值。
作为贴壁生长的肿瘤细胞,A549 培养条件简单(DMEM+10% FBS,37℃+5% CO₂即可稳定生长),且对基因编辑工具(CRISPR-Cas9、慢病毒)耐受性好,点突变效率高 —— 相比其他难编辑的肿瘤细胞,A549 能让科研人员更高效地获得稳定的 ADAR 点突变株。
3. A549 涵盖多种肿瘤表型,可多维度研究 ADAR 功能
A549 细胞具有典型的肺癌细胞特征:比如高侵袭性(Transwell 实验中易穿膜)、对化疗药(如顺铂)有一定耐药性、能形成肿瘤球(模拟体内肿瘤微环境),这些表型为研究 ADAR 点突变对肿瘤 “增殖、侵袭、耐药” 的影响提供了丰富的实验方向。
四、关键应用:A549-ADAR 点突变细胞系能解决哪些科研问题?
在NCBI中输入关键词ADAR,有2365篇相关研究文献,且最近几年的研究逐年呈上升趋势。ADAR 点突变不是 “随便改个碱基”,而是针对 ADAR1 的功能关键位点(如催化结构域的 E861A、D543A,或核定位信号位点)进行突变,从而获得 “功能激活型” 或 “功能缺失型” 细胞系。结合文献报道,它的核心应用主要有 3 个方向:
1. 解析 ADAR 点突变在肺癌 RNA 编辑中的 “靶标图谱”找到肿瘤特异性编辑位点
研究思路:用A549-ADAR 功能缺失突变株(如催化结构域突变 E861A,无法进行 A-to-I 编辑)与野生型 A549 细胞对比,通过 RNA-seq(转录组测序)结合编辑位点分析(如 REDItools 工具),筛选出 ADAR 调控的 “肺癌特异性 RNA 编辑靶标”。
文献支撑:Nature Communications 2022 年一篇研究用类似思路,发现 ADAR1 在 A549 细胞中会特异性编辑抑癌基因TP53的 mRNA 3'UTR,通过改变 microRNA 结合位点,导致TP53表达下调;而 ADAR 点突变后,TP53编辑减少、表达恢复,肿瘤细胞增殖被抑制。这一发现为肺癌的 “RNA 编辑靶向治疗” 提供了新靶点。
科研灵感:可以进一步筛选ADAR 在 A549 中的新编辑靶标,比如长链非编码 RNA(lncRNA)或 circRNA,探索这些 RNA 的编辑如何影响肺癌细胞的恶性表型。
2. 研究ADAR 点突变对肺癌细胞 “侵袭转移” 的影响
研究思路:ADAR1 高表达被认为与肺癌的侵袭转移相关,可通过 “划痕实验”“Transwell 侵袭实验” 对比 A549-ADAR 点突变株与野生株的迁移能力;同时检测上皮 - 间质转化(EMT)标志物(如 E - 钙黏蛋白、N - 钙黏蛋白)的表达变化,明确 ADAR 点突变是否通过调控 EMT 影响转移。
文献案例:Cancer Research 2021 年研究发现,A549 细胞中 ADAR1 通过编辑ZEB1(EMT 关键转录因子)的 mRNA,增强ZEB1的稳定性;当 ADAR 发生功能缺失突变后,ZEB1编辑减少、降解增加,E - 钙黏蛋白表达升高,细胞侵袭能力显著下降,这说明 ADAR1 是肺癌转移的 “促进因子”,而点突变可逆转这一过程。
科研灵感:可以结合“肿瘤微环境” 进一步研究,比如将 A549-ADAR 点突变株与巨噬细胞共培养,观察 ADAR 点突变是否影响细胞与微环境的相互作用,进而调控转移。
3. 探索 ADAR 点突变与肺癌 “化疗耐药” 的关系 —— 为临床用药提供参考
研究背景:化疗耐药是肺癌治疗的一大难题,而ADAR1 被报道与顺铂、紫杉醇等化疗药的耐药相关。A549 细胞对顺铂有一定耐药性,是研究耐药机制的理想模型。
研究思路:用不同浓度的顺铂处理A549-ADAR 点突变株与野生株,通过 CCK-8 实验检测细胞活力,计算 IC50(半数抑制浓度),判断 ADAR 点突变是否能逆转耐药;同时检测耐药相关基因(如ABCB1、MRP1)的表达,或 DNA 损伤修复蛋白(如 ATM、BRCA1)的活性,揭示耐药机制。
文献支撑:Journal of Hematology & Oncology 2023 年研究显示,A549 细胞中 ADAR1 通过编辑ATM mRNA,增强 ATM 的活性,促进 DNA 损伤修复,从而对顺铂产生耐药;当 ADAR 发生点突变后,ATM编辑减少、活性降低,细胞对顺铂的敏感性显著提高,这提示 ADAR1 可能是逆转肺癌化疗耐药的 “潜在靶点”。
科研灵感:可以拓展到“靶向药耐药” 研究,比如检测 ADAR 点突变对 EGFR-TKI(如吉非替尼)耐药的影响,探索联合 ADAR 抑制剂与靶向药的治疗效果。
如果你正在关注肺癌的RNA编辑机制、肿瘤转移或化疗耐药,不妨试试这个细胞系,或许你能发现 ADAR 调控肺癌的新靶标,甚至为临床治疗提供新的思路。可关注粒曼生物点突变现货细胞:
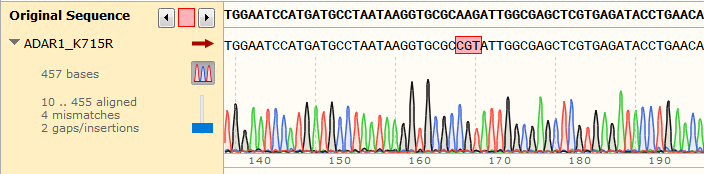
细胞名称:A549 │ 基因名称:ADAR1 │ 突变位点:K715R(AAG>CGT)│技术路线:RNP+HDR法 │ 点突变纯合子
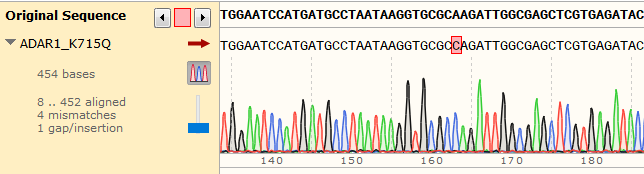
细胞名称:A549 │ 基因名称:ADAR1 │ 突变位点:K715Q(AAG>CAG)│技术路线:RNP+HDR法 │ 点突变纯合子