产品发布|粒曼支原体MycoScan™检测试剂盒【附实验室支原体控制流程图】
2025-05-20
一、为何要关注支原体?
支原体直径约为0.1-0.3 μm,是一种缺乏细胞壁的原核微生物,介于细菌和病毒之间。具有变形能力,可透过常见过滤膜(0.22-0.45 μm),因此常规的无菌过滤方法不能将其去除,许多常用的抗生素也对支原体无效。
支原体污染是细胞培养领域的一个世界性问题,世界各国细胞系支原体污染的平均比例为30-60%。从2013年开始,《Nature》期刊已正式要求投稿的文章,如涉及细胞培养都要进行支原体检测。以细胞为载体的科学研究,如果不能保证所用的细胞无支原体污染,则实验结果也是不可信的。因此在细胞培养中,支原体的检测至关重要。
二、常见的支原体检测方法及优缺点
2.1 培养法
将待检测的样本接种到适合支原体的培养基中。如果在特定条件下培养后,能够观察到支原体特有的菌落形态或生长迹象,就表明样本中存在活的支原体。这种方法是检测支原体的一个经典途径,被许多药典(如欧洲药典、美国药典)视为“金标准”方法之一。
优点:
- 检测活菌:能够直接证明样本中存在具有活性的、能够增殖的支原体。
- 高特异性:由于需要特定的生长条件和观察特征菌落,假阳性率相对较低(如果操作规范)。
- 权威性:被多国药典收录,是法规认可的标准方法。
缺点:
- 耗时长:整个培养和观察过程至少需要4天,无法满足快速检测的需求。
- 操作复杂:需要专门的培养基配制、严格的无菌操作技术和适宜的培养环境。
- 灵敏度局限:对于某些生长缓慢或有特殊营养要求的支原体菌株,可能检测不到或需要更长时间。
- 对操作者要求高:需要经验丰富的技术人员进行菌落形态的判读。
应用场景:培养法虽然耗时,但在需要最终确认支原体污染,尤其是在药品、疫苗等生物制品的质量控制放行检测,以及验证其他快速检测方法的有效性时,仍然扮演着不可或缺的角色。
2.2 酶联免疫吸附试验(ELISA)/血清学检测
原理:利用抗原抗体特异性结合的原理。如检测支原体常用的双抗体夹心法,就是将捕获抗体包被在固相载体上,加入待检测样本,样本中的支原体就会特异性的和捕获抗体结合,洗掉多余的杂质。再加入另一种也能够识别该支原体抗原(但通常是识别抗原上不同位点)的“信号抗体”(酶标抗体)。再次洗涤,去除未结合的酶标检测抗体,加入酶的底物,酶标抗体上的酶会催化底物发生化学反应,产生有颜色的产物。颜色的深浅通常与样本中支原体抗原的含量成正比。通过酶标仪测定吸光度,就可以计算判断样本中是否存在支原体以及其大致的含量。
优点:
- 相对快速:相比培养法,ELISA通常几个小时内就能得到结果。
- 操作相对简便:易于标准化,适合进行批量样本的检测,也可以实现自动化。
- 灵敏度和特异性较好:高质量的试剂盒可以提供不错的检测效果。
局限性:
- 通常不能区分死菌与活菌:它检测的是支原体的抗原成分,即使支原体已经死亡,只要抗原还存在,仍可能检出阳性。
- 可能存在交叉反应:如果选用的抗体特异性不够好,可能会与其他微生物或样本中的某些成分发生交叉反应,导致假阳性。
- 试剂盒依赖性:检测结果的好坏很大程度上取决于所用ELISA试剂盒的质量,包括抗体的特异性、灵敏度等。
- 不同支原体种属的覆盖:需要确保所用试剂盒能够检测到目标范围内可能存在的各种支原体种类。
2.3 荧光染色法
原理:使用DNA荧光染料(如Hoechst33258、DAPI等)对细胞进行染色,染料会结合到DNA中富含A-T的区域,由于支原体的DNA中A-T含量占多数(55%~80%),所以可被染色而检测到,无污染细胞只有细胞核着色,而受污染细胞细胞质及细胞周围会出现大小、形态不规则的荧光着色。
优点:设备简单,操作便捷,周期短。
缺点:特异性差,其他微生物上的DNA也可能结合荧光染料产生荧光信号,容易出现假阳性。
2.4 PCR(分子生物学检测)
原理:通过扩增支原体基因组中高度保守的16S rRNA 编码区序列,从而实现对不同种的属的支原体进行检测;常见支原体类型如下:
(1)常规PCR法
优点:灵敏度高、特异性高、检测周期较短。
缺点:对仪器要求高(需要准备PCR仪,电泳仪、成像仪等设备)、操作较复杂。
(2)巢式PCR法
设计两对引物(外围引物与内围引物),进行两次PCR扩增反应。第一次PCR用外围引物的将支原体保守区DNA进行大量扩增,以内围引物对第一次PCR产物其进行第二次扩增。此方法极大地提高了灵敏度和特异性,可检测微量污染。
优点:灵敏度很高、特异性很高、检测周期较短。
缺点:对仪器要求高(需要准备PCR仪,电泳仪、成像仪等设备)、操作较复杂。
(3)等温扩增法
优点:实验条件简单,对操作和设备要求低(在恒温条件下实验,直接观察颜色判断)。
缺点:当支原体污染为弱阳性的情况下,颜色的变化可能不明显,容易造成误判或错读。
2.5 扫描电子显微镜法
原理:利用电子显微镜的超级放大功能,直接观察培养细胞中支原体污染情况
优点:非常直观、准确。
缺点:对仪器及使用环境要求高,操作复杂,成本高,实验周期较长,常作为样品的最后定性检测。
三、粒曼支原体MycoScan™检测试剂盒介绍
粒曼生物公司MycoScan™试剂盒采用“聚合酶链式反应(PCR)”技术,特异性检测细胞培养中的支原体污染。通过扩增支原体基因组中高度保守的16S rRNA 编码区,本试剂盒可特异性实现对Mycoplasma(支原体)、Acholeplasma(无胆甾原体)和 Ureaplasma(脲原体)三大类菌属的高效检测,覆盖95%以上常见的细胞培养污染源。

核心优势
✔ 高灵敏度:可检测低至 2-5 fg/100 µL 的支原体DNA
✔ 高特异性:仅扩增支原体DNA,不干扰真核细胞或其他细菌DNA
✔ 快速检测:3小时内即可获得结果
✔ 内参对照:含内部对照(Internal Control),避免假阴性
✔ 阳性对照:提供 M. orale(503 bp)作为扩增对照
检测原理
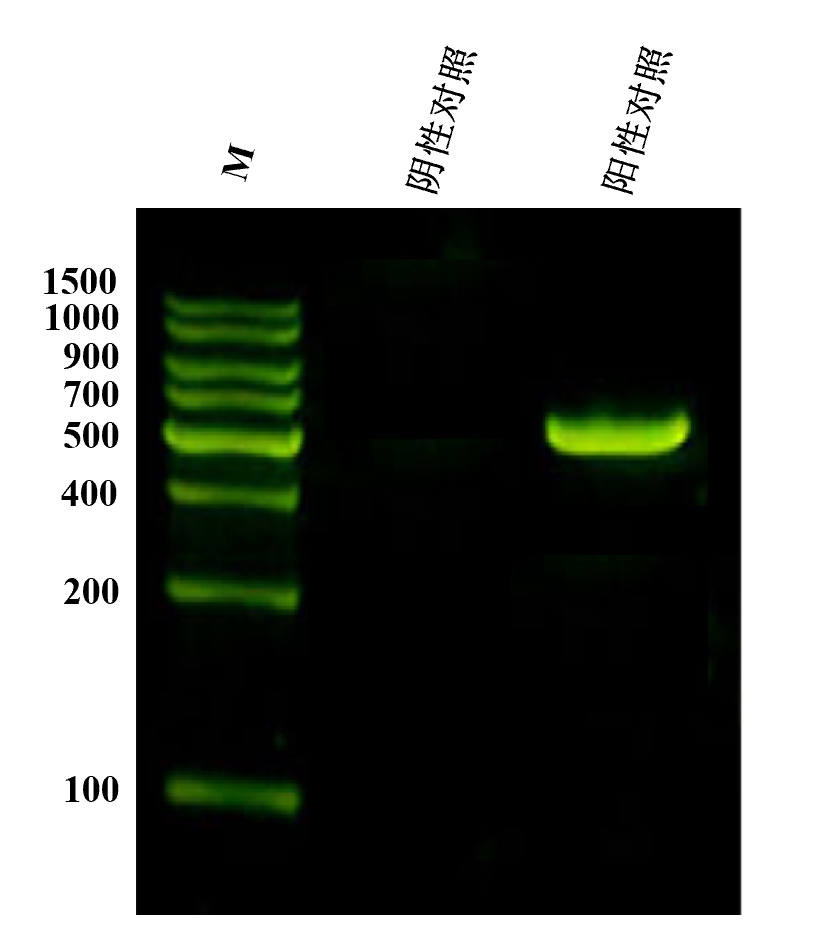
PCR扩增:
- 阳性样本 → 产生 ~448-611 bp 条带(具体大小因支原体种类而异)
- 阳性对照(M. orale)→ 503 bp 条带
扩增图片示例:
欢迎咨询粒曼团队,获取支原体MycoScan™检测试剂盒试用装!
四、粒曼实验室支原体检测控制流程
- 粒曼实验室严格控制实验室内支原体污染,通过“多维度、多阶段”对细胞系来源、构建过程等进行全面的质量控制。
- 粒曼团队将该控制流程图发布于“杞梓认证”标准中,呼吁客户及同行借鉴该流程,并达成共识:承诺不使用“支原体污染祛除试剂”!(实质无法祛除支原体,一旦发生污染,最有效的方式就是处理掉该批次细胞)
- 粒曼团队通过针对外部来源细胞连续培养8代之后进行支原体检测(该代次细胞只用于支原体检测),排除由于“支原体祛除试剂”的使用,而未发生支原体污染的潜在风险。
- 粒曼提供高性价比“支原体MycoScan™检测试剂盒”,让您的细胞房尽可能减少支原体污染,让您的细胞实验结果更具科学性和可重复性!
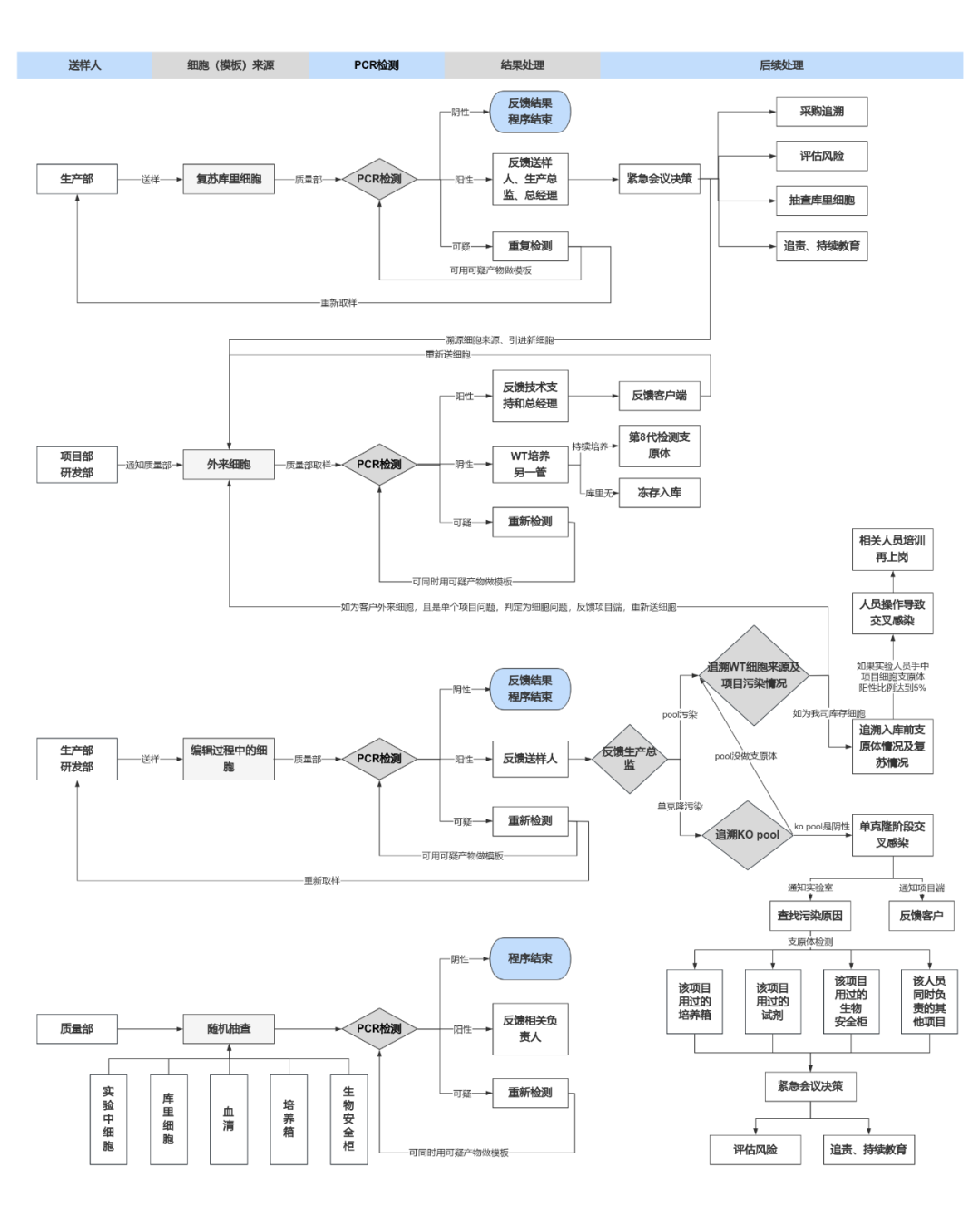
粒曼生物支原体控制工作流程图
2025 /
05-20
所属分类:
公司新闻
相关资讯—
2025-12-01
2025-12-01

