产品发布|粒曼Gene tagging: N/C端原位插入,助力相分离/临近标记/蛋白降解等热门领域
2025-05-26

在功能基因组学研究中,我们常常希望能够精准标记或调控内源基因,而不改变其表达调控和功能特性。相比外源过表达(OE),在内源位点实现N端或C端原位插入标签或功能模块,成为研究蛋白表达、定位、互作和动态调控的“黄金策略“,近几年在液液相分离、临近标记及蛋白降解等领域,逐步变为常规技术手段。
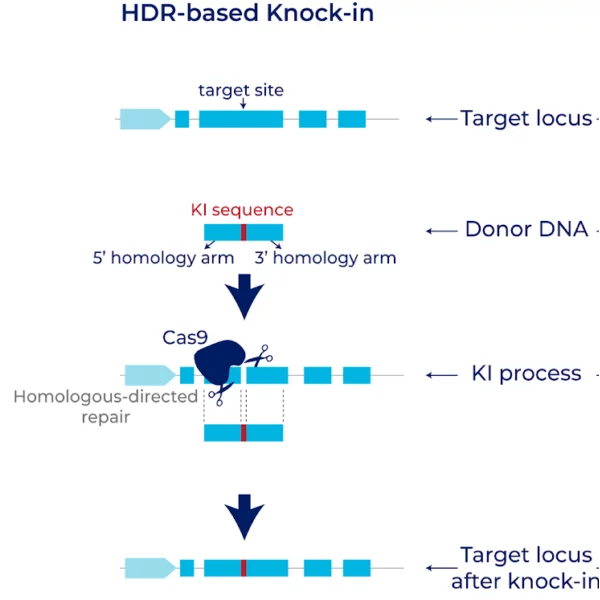
一、什么是Gene tagging N/C端原位插入?
原位插入(Endogenous Knock-in)是指将通过CRISPR/Cas9系统,将外源标签(如GFP、HiBiT、FLAG、TurboID等)精确地插入到目标基因的N端或C端,使其在原生启动子驱动下表达,保留天然调控背景。
-
N端插入:标签或功能模块融合在目标蛋白的起始密码子前;
-
C端插入:标签位于目标蛋白终止密码子前,与其翻译产物融合。
相比传统的随机整合或强启动子驱动表达,原位插入更接近细胞内真实生理状态,特别适合蛋白质定位、表达量调控和互作研究。
-
表达量接近生理水平;
-
时空表达于天然一致;
-
亚细胞定位更加真实。
参考阅读:全面比较TurboID原位敲入(KI)与过表达(OE)在邻近标记实验中的性能差异,结果显示KI组显示出一系列高度显著的真实互作蛋白,背景蛋白较少;而 OE组虽检测到更多蛋白,但高背景掩盖了真实互作。
技术专题 | 破解细胞内蛋白互作密码:邻近标记技术在生物研究中的价值与选择策略【收藏】
二、Gene tagging应用标签以及功能示例
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
三、参考案例分享
案例一:HiBiT细胞系构建用于蛋白表达动态监测
客户需求:在HEC-T细胞中A基因的C端原位插入HiBiT标签
1. 确定内源基因基础表达后,设计方案如图1所示:
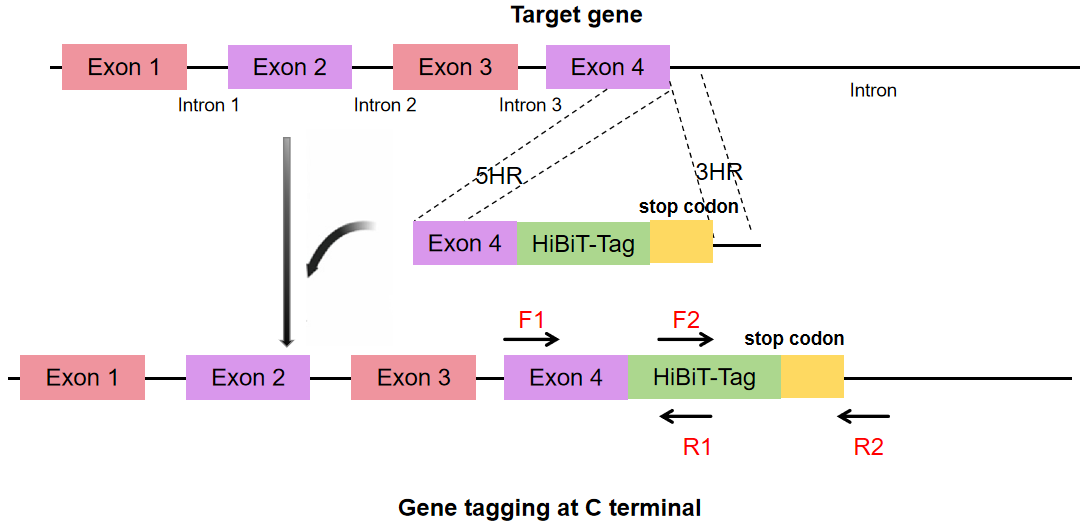
图1
2.细胞系构建完成后本司采用Sanger 测序与HiBiT表达验证同时鉴定原位插入片段是否成功。
Sanger 测序显示目的基因A-C端正确插入HiBiT标签(如图2)
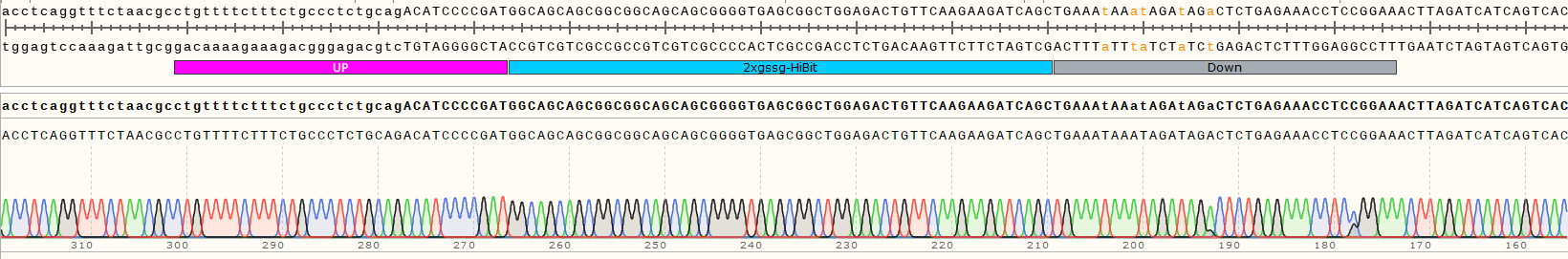
图2
3.HiBiT表达验证:细胞构建完成后本司会进行HiBiT标签的功能性验证,在HEC-T细胞A 基因C端原位插入HiBiT标签,HiBiT正常表达表明HCE-T细胞A基因C端原位插入HiBiT标签成功,监测HiBiT信号可以实时检测基因A的内源性表达情况。(如图3)
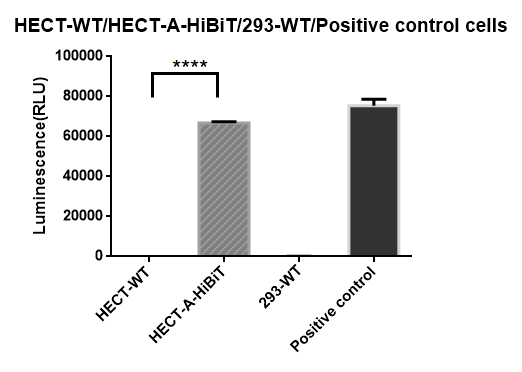
图3
案例二:原位插入荧光蛋白细胞系用于研究基因定位
客户需求:在Htert-RPE1细胞R基因的C端原位插入EGFP
1.确定客户需求后,设计方案如图1所示:
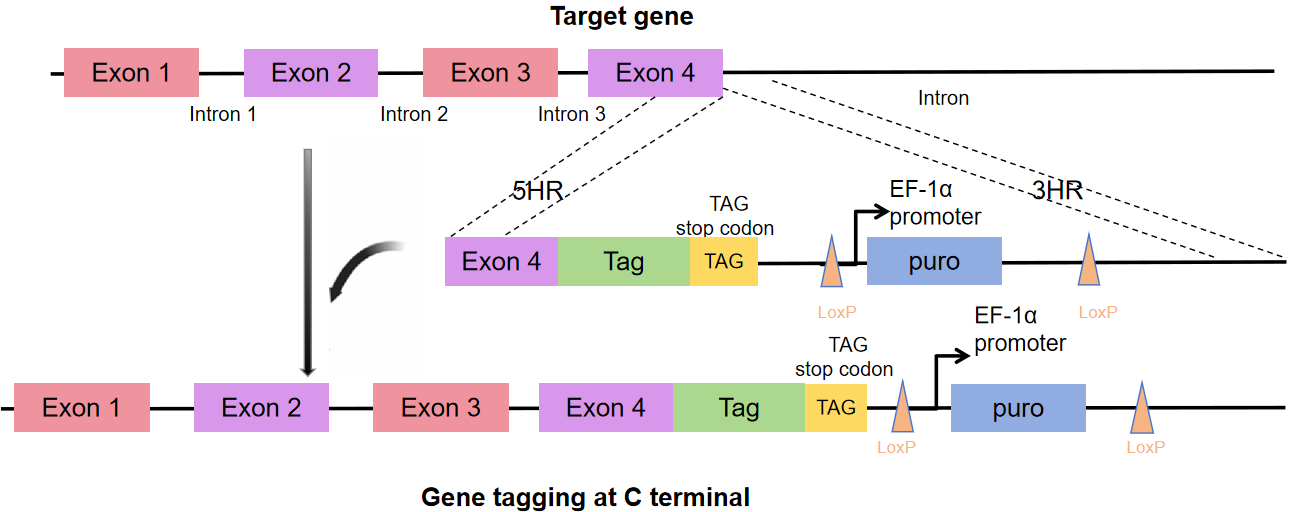
图1
2.细胞系构建完成后本司采用Sanger 测序鉴定原位插入片段是否成功。Sanger 测序显示目的基因R-C端正确插入EGFP标签(如图2)

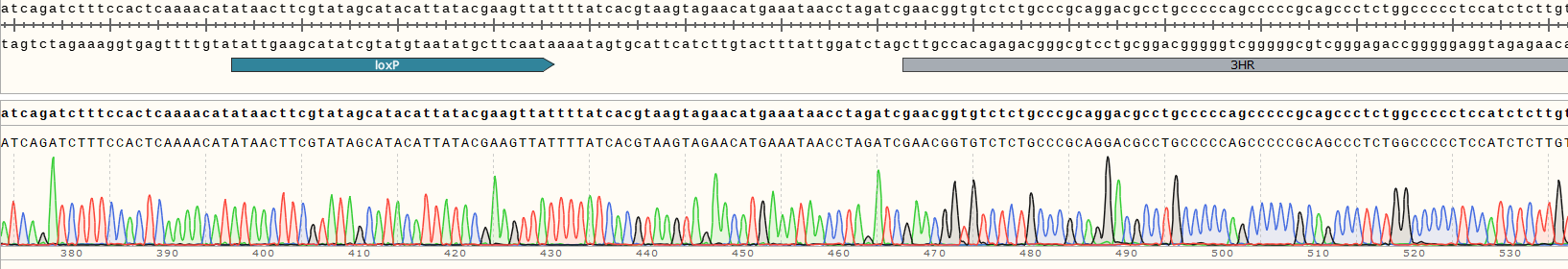
图2
3.eGFP表达以及定位验证:细胞构建完成后进行eGFP标签的功能性验证,IF结果显示,eGFP发光且定位正确,综上Htert-RPE1细胞R基因C端原位插入eGFP标签成功。(如图3)
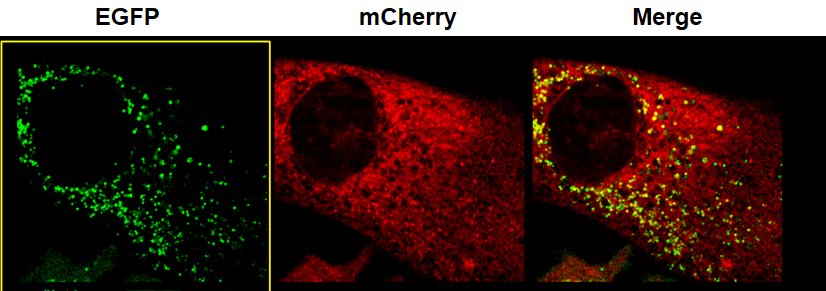
图3
三、其他参考应用场景
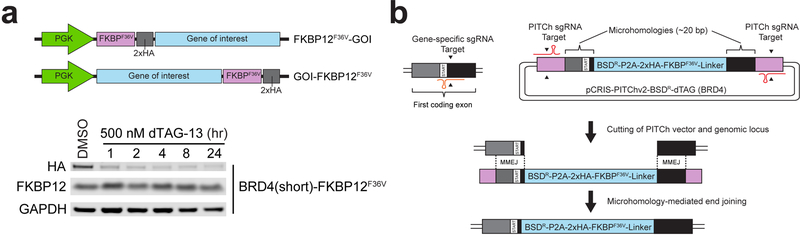
1. 原位插入dTAG(FKBP12)研究蛋白降解
研究人员在人MOLM-13白血病细胞中[1],利用CRISPR/Cas9将FKBP12(F36V)标记C端插入BRD4基因,实现内源BRD4的可控降解。 通过dTAG-13处理,BRD4蛋白迅速降解,转录程序大规模改变,验证BRD4为AML细胞存活依赖的靶点,为验证靶点功能提供了强有力工具。
2. 研究内源基因的表达和定位
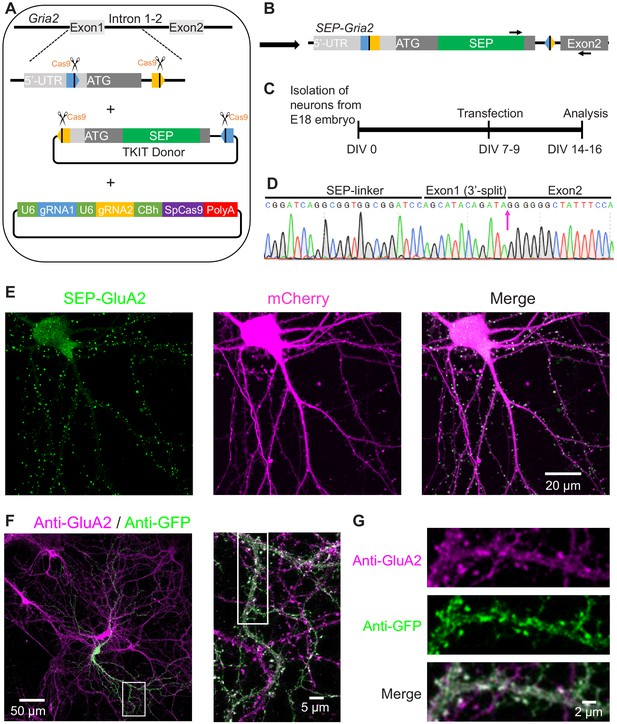
研究人员利用原位插入的方式将SEP插入到神经元内源基因的N端,SEP信号与神经元标记蛋白共定位,为神经元中内源基因的研究提供新的策略[2]。
3. 研究相分离的形成以及作用机制
研究人员利用原位插入的方法构建ZFP207GFP-KI]/70mScarlet-KI 细胞系[3],随后进一步利用凝聚体形成实验和显微成像分析,证明了ZFP207与U1 snRNP在生理条件下形成一类新型核内凝聚体,该凝聚体与已知的核斑、旁斑、Cajal小体等均不相同,但与核斑存在动态互作,且其互作模式受转录或剪接抑制的影响。并且证明了ZFP207是这一凝聚体高效形成的关键因子。

4. 原位插入邻近标记研究蛋白互作
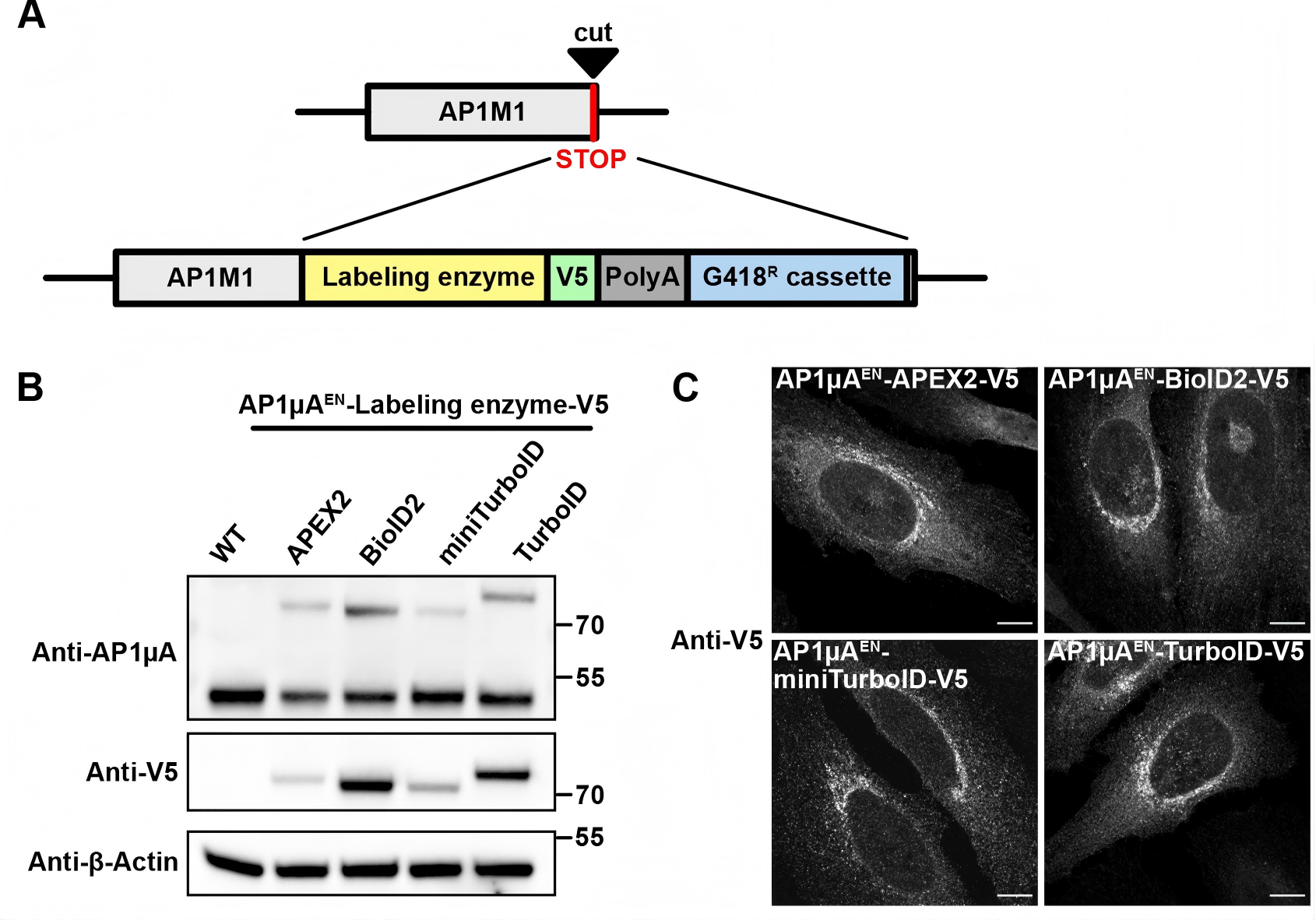
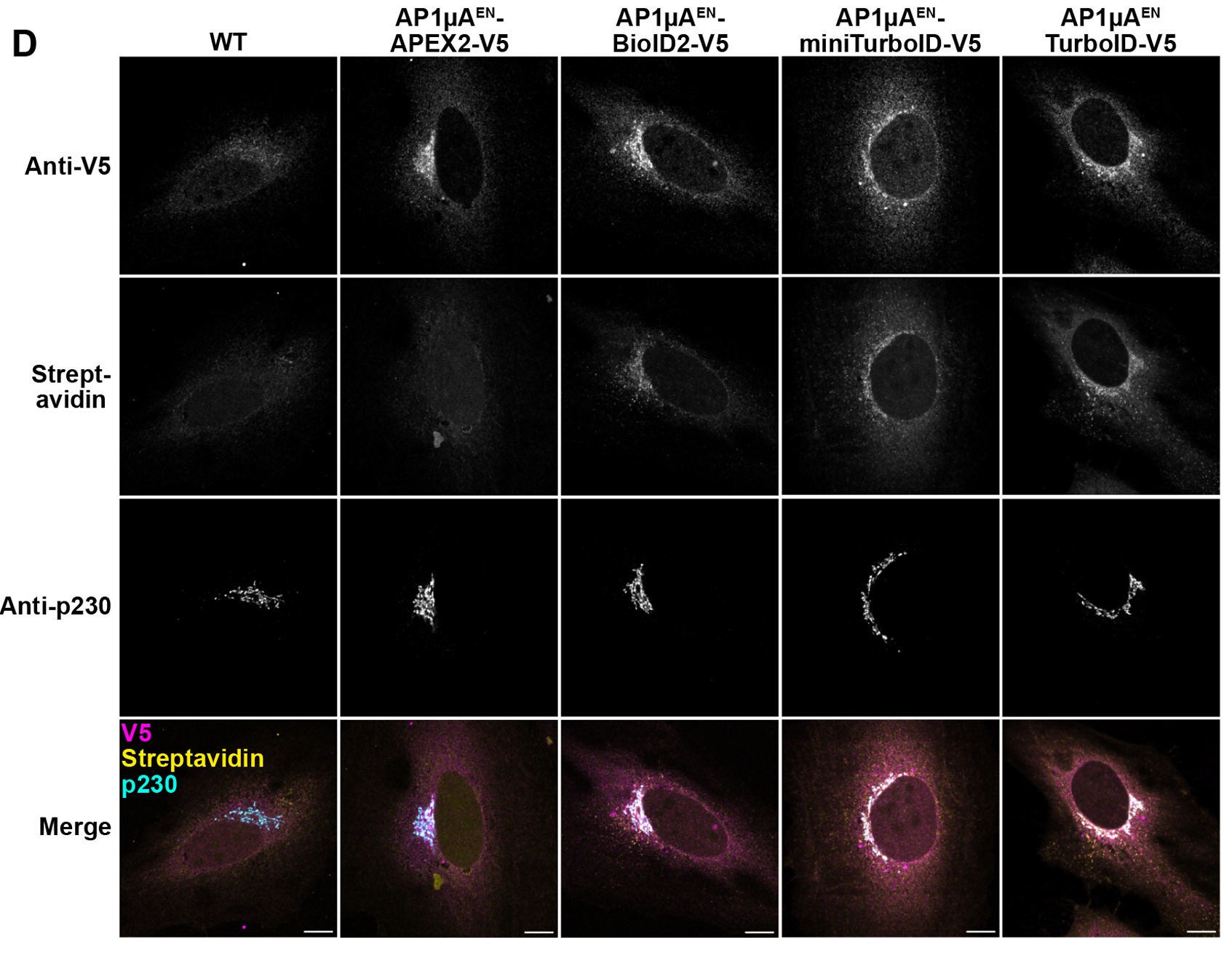
研究人员利用原位插入的方法将 APEX2、BioID2、miniTurboID 和 TurboID 融合在 HeLa 细胞AP1µA 基因的 C 端,寻找该基因潜在的互作蛋白,同时比较了不同标记酶的特异性[4]。
四、粒曼提供Gene tagging原位插入定制服务
粒曼团队拥有多年基因编辑经验,成功案例丰富;支持多种标签、多种细胞系(HeLa, HEK293T, A549, hPSC等);免费初步评估以及可行性分析;可定制组合标签插入构建,我们为您提供一站式细胞系构建服务。
1)方案设计:标签选择(GFP、HiBiT、TurboID等);N端或C端插入位点分析;sgRNA和Donor模板精准设计。
2)CRISPR编辑:高效转染或病毒系统;基因组水平验证(PCR、测序);单克隆筛选。
3)表达验证(附加服务):WB、免疫荧光或HiBiT功能检测;确保标签融合表达正确。
4)项目交付:提供编辑单克隆细胞株;含详细验证报告、质粒设计资料。
参考文献
[1]Nabet B, et al.The dTAG system for immediate and target-specific protein degradation. Nat Chem Biol. 2018 May;14(5):431-441.
[2]Huaqiang Fang,et al.An optimized CRISPR/Cas9 approach for precise genome editing in neurons eLife 10:e65202.
[3]Zhou Y, et al. Condensation of ZFP207 and U1 snRNP promotes spliceosome assembly. Nat Struct Mol Biol. 2025 Mar 6.
[4]Stockhammer A, et al. When less is more - a fast TurboID knock-in approach for high-sensitivity endogenous interactome mapping.J Cell Sci.2024 Aug 15;137(16):jcs261952.
2025 /
05-26
所属分类:
公司新闻
相关资讯—
2025-12-01
2025-12-01

